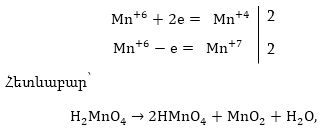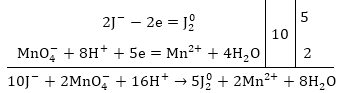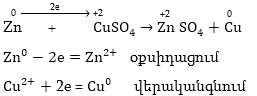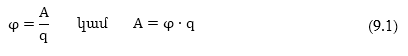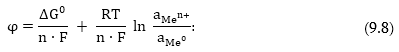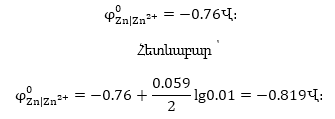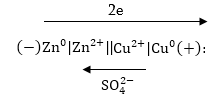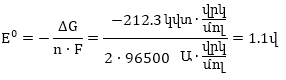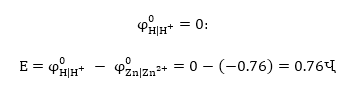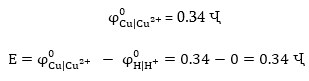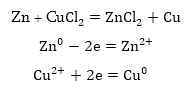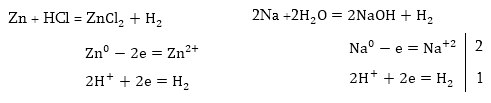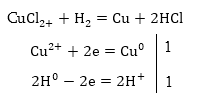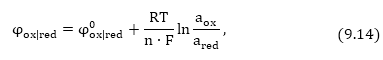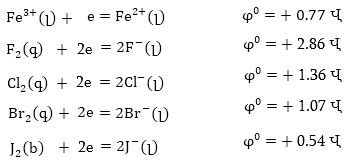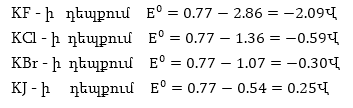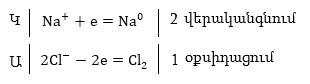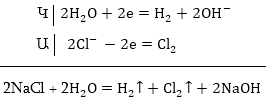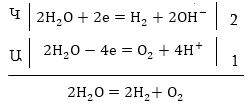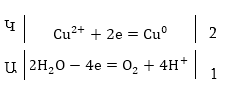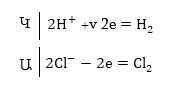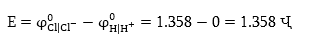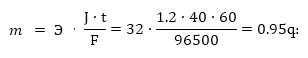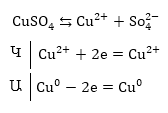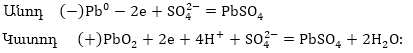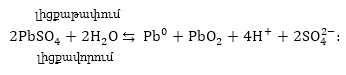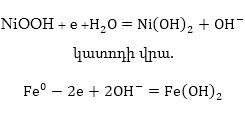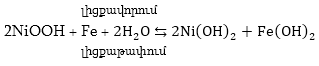ՀՏԴ
Օքսիդացման-վերականգնման
ռեակցիաներ:Էլեկտրաքիմիա:
Ուսումնական
ձեռնարկ Ֆ.Գրիգորյան,
Ա.Գրիգորյան: Հայաստանի
պետական ճարտարագիտական
համալսարան: Երևան
2005թ.:
Նախատեսված
է Քիմիա-տեխնոլոգիական
և բնապահպանական
ճարտարագիտություն
մասնագիտության
ուսանողների, մագիստրանտների
և ասպիրանտների
համար:
Գրախոսներ՝
Հ.
Մխիթարյան
Ռ.
Միրզախանյան
Խմբագիր՝
Ն.
Խաչատրյան
Բովանդակություն
8.Օքսիդացման
- վերականգնման
ռեակցիաներ
8.1. Վալենտականություն
և օքսիդացման աստիճան
8.2.
Օքսիդացման աստիճանի
որոշումը
8.3.
Օքսիդացման վերականգնման
ռեակցիաներ: Օքսիդացում
և վերականգնում,
օքսիդիչ և վերականգնիչ
8.4.
Օքսիդացման վերականգնման
ռեակցիաների տեսակները,
դրանց հավասարումների
կազմումը էլեկտրոնային
հաշվեկշիռեղանակով
8.5.
Միջավայրի և պայմանների
ազդեցությունը
նյութերի օքսիդիչ
վերականգնիչ հատկությունների
վրա
8.6.
Օքսիդացման վերականգնման
ռեակցիաների հավասարումների
կազմումը իոնա-էլեկտրոնային
եղանակով
9.
Էլեկտրաքիմիա
9.1. Գալվանական
էլեմենտների տեսություն
9.1.1. Էլեկտրոնային
պոտենցիալ
9.1.2.
Էլեկտրոդային
պրոցեսների թերմոդինամիկան
9.1.3
Դանիել-Յակոբիի
գալավանական էլեմենտը
9.1.4.
Գալվանական էլեմենտի
էլեկտրաշարժ ուժը
9.1.5.
Էլեկտրոդային
պոտենցիալի չափումը:
Ջրածնական էլեկտրոդ
9.1.6.
Մետաղների ստանդրտ
էլեկտրոդային
պոտենցիալների
(լարվածության)
շարքը
9.1.7.
Օքսիդացման - վերականգնման
ռեակցիաների ընթացքի
ուղղության որոշումը
9.2.
Էլեկտրոլիզ
9.2.1.
Ընդհանուր հասկացությունները
9.2.2.
Անոդային օքսիդացում
և կատոդայն վերականգնում
9.2.3.
Իոնների լիցքաթափման
հաջորդականությունը
էլեկտրոլիզի ժամանակ
9.2.4.
Չլուծվող անոդով
էլեկտրոլիզի օրինակներ
9.2.5.
Քայքայման պոտենցյալ
9.2.6.
Էկեկտրոլիզի քանակական
բնութագիրը, Ֆարադեյի
օրենքները
9.2.7.
Լուծվող անոդով
էլեկտրոլիզ
9.2.8.
Էլեկտրոլիզի կիրառությունը
9.3.
Մետաղների կոռոզիա
9.3.1
Հիմնական հասացություններ
9.3.2
Մետաղների պաշտպանումը
կոռոզիայից
9.4.
Էլեկտրակուտակիչներ
Ամփոփում
Սովորելու
նպատակը
Հիմնական
հասկացություններ
8.
Օքսիդացման վերականգնման
ռեակցիաներ
8.1
Վալենտականություն
և օքսիդացման աստիճան
Վալենտականությունը բնորոշում
է տարրի ատոմի
իրեն որոշակի թվով
այլ ատոմներ միացնելու
հատկությունը:
Վալենտականությունը
տվյալ ատոմի՝այլ
ատոմիների հետ
առաջացած կապերի
թիվն է:
Ըստ
վալենտային կապերի
մեթոդի՝ տվյալ
ատոմների առաջացրած
կապերի թիվը էլեկտրոնոյին
որոշվում է այլ
ատոմների հետ առաջացած
ընդհանուր էլեկտրոնային
զույգերի թվով:
Վալենտականությունը
նշվում է հռոմեական
թվերով:
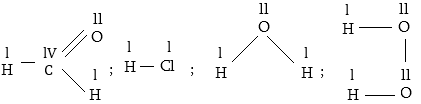
Տարրի
ատոմի վիճակը միացություններում
ավելի հստակ որոշվում
է դրա օքսիդացման
աստիճանով:
Տարրի
ատոմի օքսիդացման
աստիճանը այն պայմանական
լիցքն է, որը կունենար
ատոմը միացության
մեջ, եթե վերջինս
կազմված լիներ
իոններից:
Օրինակ
HClի մոլեկուլում
կա բևեռային կովալենտ
կապ: Եթե այդ կապը
խզվի, էլեկտրոնային
զույգը կմնա քլորի
կողմը 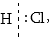 ուստի
ջրածնի օքսիդացման
աստիճանը կլինի
+1, իսկ քլորինը՝
-1:
ուստի
ջրածնի օքսիդացման
աստիճանը կլինի
+1, իսկ քլորինը՝
-1:
NaCl-ի
իոնական միացություններում
էլեկտրոնային
զույգը գործնականում
լրիվ պատկանում
է քլորին, և դարձյալ
նատրիումը կունենա
+1, իսկ քլորը՝ -1 օքսիդացման
աստիճան:
Հետևաբար
օքսիդացման աստիճանը
որշվում է լրիվ
կամ մասամբ տեղաշարժված
էլեկտրոնների
թվով, ընդ որում,
եթե էլեկտրոնային
զույգը տեղաշարժված
է տվյալ ատոմից,
այն ունի դրական,
իսկ դեպի տվյալ
ատոմը՝ բացասական
նշան:
Եթե
փոխազդող ատոմների
էլեկտրաբացասականությունները
հավասար են, և ընդհանուր
էլեկտրոնային
զույգը տեղաշարժված
չէ՝ օրինակ H:H, ապա
կապը խզվելու դեպքում
էլեկտրոնային
զույգը
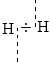
կկիսվի,
լիցք չի առաջանա,
ուստի օքսիդացման
աստիճանը կլինի
զրո: Օքսիդացման
աստիճանը գրվում
է տարրի նշանի
վերևում արաբական
թվերով, լիցքը՝
թվից առաջ
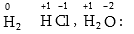
Այս
օրինակներում
տարրերի օքսիդացման
աստիճանը և վալենտականությունը
մեծությամբ հավասար
են և տարբերվում
են միայն նշանով:
Սակայն դա միշտ
չէ, որ այդպես է:
Օրինակ ջրածնի
պերօքսիդում H2O2
ջրածինը միավալենտ
է, իսկ թթվածինը՝
երկվալենտ H-OO-H, մինչդեռ
ջրածնի օքսիդացման
աստիճանը +1 է, իսկ
թթվածնինը՝-1, որովհետև
O-O պերօքսիդային
կապում ընդհանուր
զույգը տեղաշարժված
չէ: Վերը բերված
մրջնալդեհիդի
մեջածխածինը քառավալենտ
է,սակայն դրա օքսիդացման
աստիճանը զրո է,քանի
որ երկու էլեկտրոնային
զույգ տեղաշարժված
է դեպի իրեն, իսկ
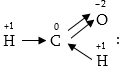
Երկուսը`իրենից
>>
8.2
Օքսիդացման աստիճանի
որոշումը
1. Որոշ տարրեր
միացություններում
հանդես են բերում
հաստատուն օքսիդացման
աստիճաններ: Դրանք
հիմնականում
I, II և III խմբերի գլխավոր
ենթախմբերի տարրերն
են
Li+1, Na+1,
K+1, Rb+1, Cs+1
Be+2, Mg+2,
Ca+2, Sr+2, Ba+2
Al+3 և
այլն:
2. Ջրածինը
միացություններում
մեծ մասամբ ցուցաբերում
է +1, բացառությամբ
հիդրիդների, որտեղ
ունի -1 օքսիդացման
աստիճան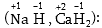
3.
Թթվածինը, ունենալով
մեծ էլեկտրաբացասականություն,
հիմնականում ցուցաբերում
է -2 օքսիդացման
աստիճան, բացառությամբ
ֆտորի հետ կազմած
միացության 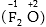 և պերօքսիդների`
և պերօքսիդների`
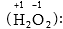
4.
Միացություններում
բոլոր ատոմների
օքսիդացման աստիճանների
հանրահաշվային
գումարը հավասար
է զրոյի, քանի որ
մոլեկուլը ամբողջությամբ
էլեկտրաչեզոք
է:
Ելնելով
այս սկզբունքից՝
հնարավոր է հաշվել
փոփոխական օքսիդացման
աստիճանները տվյալ
միացության մեջ:
Օրինակ կալիումի
պերմանգանատի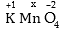 նշանակելով
Mnի օքսիդացման
աստճանը x-ով՝ կունենանք
նշանակելով
Mnի օքսիդացման
աստճանը x-ով՝ կունենանք
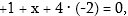 ուստի x =
+7; կալիումի դիքրոմատում՝
ուստի x =
+7; կալիումի դիքրոմատում՝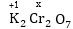
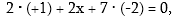 ուստի
x=+6:
ուստի
x=+6:
Ելնելով
նույն սկզբունքից,
եթե հայտնի են
տարրերի ատոմների
օքսիդացման աստիճանները,
կարելի է կազմել
դրանց միացության
բանաձևը: Օրինակ,
եթե հայտնի է, որ
ալյումինի օքսիդացման
աստիճանը +3 է, իսկ
թթվածնինը՝ -2, ապա
գտնելով այդ թվերի
ամենափոքր ընդհանուր
բազմապատիկը
(6) և բաժանելով դրանց,
կստանանք ինդեքսները՝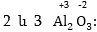
Պարզ
իոններից կազմված
միացություններում
տարրերի օքսիդացման
աստիճանները հավասար
են համապատասխան
իոնների լիցքերին
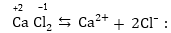
Բարդ
իոններում տարրերի
օքսիդացման աստիճանների
գումարը հավասար
է իոնի լիցքին՝
օրինակ 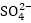 իոնում
իոնում
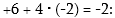
5. Տարրերի
ատոմների բարձրագույն
օքսիդացման աստիճանը
հավասար է պարբերական
համակարգում իրենց
խմբի համարին՝ 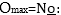 Կան առանձին
բացառություններ
(Օրինակ Cu, Ag, Au, O, F):
Կան առանձին
բացառություններ
(Օրինակ Cu, Ag, Au, O, F):
6.
Տարրերի ատոմների
ցածրագույն օքսիդացման
աստիճանը հավասար
է խմբի համարից
հանած ութ՝ 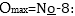 Օրինակ
ածխածինը չորրորդ
խմբի տարր է, և նրա
նվազագույն օքսիդացման
աստիճանը կլինի
48=-4:
Օրինակ
ածխածինը չորրորդ
խմբի տարր է, և նրա
նվազագույն օքսիդացման
աստիճանը կլինի
48=-4:
7. Մետաղների
օքսիդացման աստիճանը
միացություններում
միշտ մեծ է զրոյից
(Omet>0):
>>
8.3.
Օքսիդացման վերականգնման
ռեակցիաներ:
Օքսիդացում
և վերականգնում,
օքսիդիչ և վերականգնիչ
Քիմիական
ռեակցիաների մի
մասն ընթանում
է առանց մասնակցող
տարրերի օքսիդացման
աստիճանների փոփոխության,
քանի որ տեղի չի
ունենում էլեկտրոնների
անցում մի ատոմից
մյուսը:
Ռեակցիաները,
որոնց դեպքում
տեղի է ունենում
էլեկտրոնների
անցում մի ատոմից
(կամ իոնից) մյուսը,
և դրա հետևանքով
փոխվում են դրանց
օքսիդացման աստիճանները,
կոչվում են օքսիդացման
վերականգնման
ռեակցիաներ:
Օրինակ
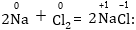
Այստեղ
նատրիումի ատոմը
տվել է մեկ էլեկտրոն
և դրա օքսիդացման
աստիճանը փոխվել
է՝ մեծանալով
0-ից մինչև +1
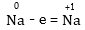
Էլեկտրոն
տալու պրոցեսը,
որն ուղեկցվում
է տարրի ատոմի
(իոնի) օքսիդացման
աստիճանի մեծացմամբ,
կոչվում է օքսիդացում:
Նատրիումի
կորցրած էլեկտրոնները
ձեռք է բերում
քլորի ատոմը
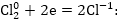
Էլեկտրոն
վերցնելու պրոցեսը,
որն ուղեկցվում
է տարրի ատոմի
(իոնի) օքսիդացման
աստիճանի փոքրացմամբ,
կոչվում է վերականգնում:
Քլորի
ատոմներին էլեկտրոններ
է տվել, վերականգնել
է նատրիումը, ուստի
այն վերականգնիչ
է:
Ատոմները,
իոնները կամ մոլեկուլները,
որոնք տալիս են
էլեկտրոններ, կոչվում
են վերականգնիչներ:
Նատրիումից
էլեկտրոններ է
վերցրել, դրան
օքսիդացրել է քլորը,
հետևաբար այն օքսիդիչ
է:
Ատոմները,
իոնները կամ մոլեկուլները,
որոնք վերցնում
են էլեկտրոններ,
կոչվում են օքսիդիչներ:
Այսպիսով՝

Հետևաբար՝
վերականգնիչը
կորցնում է էլեկտրոններ
և օքսիդանում է,
իսկ օքսիդիչը վերցնում
է էլեկտրոններ
և վերականգնվում
է:
Քիմիական
ռեակցիաներում
չեն կարող իրականանալ
միայն օքսիդացման(էլեկտրոններ
կորցնելու) և կամ
միայն վերականգնման
(էլեկտրոններ վերցնելու)
պրոցեսներ: Դրանք
իրար փոխադարձաբար
լրացնում են և
կարող են իրականանալ
միայն համատեղ:
Հետևաբար չեն կարող
լինել միայն օքսիդացման
կամ միայն վերականգնման
ռեակցիաներ:
Օքսիդացման-վերականգնման
կոչվում են այն
ռեակցիաները, որոնցում
տեղի ունի էլեկտրոնի
անցում՝ մեկ ատոմից՝
մյուսը:
Բնորոշ
վերականգնիչ նյութերն
են մետաղները,
որոնք հեշտությամբ
կորցնում են էլեկտրոններ,
իսկ լավ օքսիդիչներ
են ուժեղ ոչ մետաղները,
որոնք հեշտությամբ
վերցնում են էլեկտրոններ:
Եթե
տարրն ունի փոփոխական
օքսիդացման աստիճան,
ապա օքսիդացման
աստիճանի մեծացման
հետ մեկտեղ դրա
վերականգնիչ հատկությունները
նվազում են, օքսիդիչ
հատկություններն
աճում, ընդ որում՝
նվազագույն օքսիդացման
աստիճանի դեպքում
տարրը հանդես է
բերում միայն վերականգնիչ
հատկություններ,
քանի որ այդ դեպքում
տարրի արտաքին
էլեկտրոնային
շերտը լրացված
է և կարող է միայն
կորցնել էլեկտրոններ,
առավելագույն
օքսիդացման աստիճանի
դեպքում`միայն
օքսիդիչ հատկություններ,
քանի որ այդ դեպքում
տարրի ատոմը կորցրել
է իր բոլոր վալենտային
էլեկտրոնները
և կարող է միայն
վերցնել, իսկ միջին
օքսիդացման աստիճանի
դեպքում ցուցաբերում
է օքսիդավերականգնման
երկվություն, այսինքն
կարող է ցուցաբերել
և օքսիդիչ, և վերականգնիչ
հատկություններ,
կախված, թե ինչպիսի
տարրի հետ է փոխազդում:
Օրինակ`
ծծումբը ցուցաբերում
է -2-ից մինչև +6 օքսիդացման
աստիճաններ

S-2-ը արտաքին
շերտում ունի
8 էլեկտրոն և կարեղ
է միայն կորցնել
էլեկտրոններ (վերականգնիչ),
S+6-ը արտաքին շերտում
էլեկտրոն չունի
և կարող է միայն
վերցնել էլեկտրոններ
(օքսիդիչ), իսկ S0-ն
և S+4-ը կարող են
թե կորցնել, և թե
վերցնել էլեկտրոններ:
>>
8.4 Օքսիդացման
- վերականգնման
ռեկցիաների տեսակները,
դրանց
հավասարումների
կազմումը էլեկտրոնային
հաշվեկշռի եղանակով
Օքսիդացման-վերականգնման
ռեկցիաները երեք
տեսակի են՝ միջմոլեկուլային,
ներմուեկուլայինև
ինքնավերականգման (անսահ-մանական)
ռեակցիաներ:
Օքսիդացման
- վերականգնման
ռեկցիաներում
վերականգնիչի
կորցրած էլեկտրոնների
թիվը անպայման
պետք է հավասար
լինի օքսիդիչի
վերցրածին, որովհետև
վերցվում է այնքան
էլեկտրոն, որքան
տրվում է և հակառակը:
Ելնելով
էլեկտրոնների
հաշվեկշռի այս
պայմանից՝ կարելի
է հաշվել փոխազդող
նյութերի այն մոլային
հարաբերությունը,
որի դեպքում այս
պայմանը կբավարարվի,
այսինքն՝ գտնել
հավասարման գործակիցները,
իսկ որոշ դեպքերում՝
ավելին, նաև կազմել
հավասարումը գտնելով
նոր նյութերի,
մասնավորապես,
ջրի մասնակցությունը
ռեակցիայի մեջ:
Միջմոլեկուլային կոչվում
են այն օքսիդացման-վերականգնման
ռեկցիաները, երբ
օքսիդիչը և վերականգնիչը
գտնվում են տարբեր
մոլեկուլների
կազմի մեջ, այսինքն՝
օքսիդավերականգնման
պրոցեսն ընթանում
է տարբեր մոլեկուլներում:
Ներմուեկուլային օքսիդացման-վերականգնման
ռեակցիաները՝
երբ օքսիդիչը և
վերականգնիչը
գտնվում են նույն
մոլեկուլում,
Այսինքն`
օքսիդավերականգնման
պրոցեսն ընթանում
է նույն մոլեկուլներում:
Ինքնաօքսիդացման-ինքնավերականգման են
այն ռեկցիաները,
որոնցում որպես
օքսիդիչ և որպես
վերականգնիչ հանդես
են գալիս միևնույն
տարրի ատոմները:
Այսպիսի ռեակցիաների
ենթարկվում են
այն նյութերը,
որոնցում պարունակվում
են տարրերի միջին
օքսիդացման աստիճան
ունեցող ատոմներ:
I. Միջմոլեկուլային օքսիդացման
- վերականգնման
ռեկցիաների հավասարումների
կազմումը
1. Պարզագույն
(հիմնական) դեպք,
երբ
ռեակցիային մասնակցում
են միայն երկու
նյութ՝ օքսիդիչը
և վերականգնիչը:
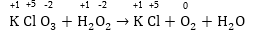
Հավասարումը
կազմելու համար
ա) Հաշվում
ենք տարրերի օքսիդացման
աստիճանները ձախ
և աջ մասերում
և համեմատելով
գտնում ենք օքսիդիչը
և վերականգնիչը:
Տվյալ դեպքում
O-1-ը կորցրել է
էլեկտրոններ, վերականգնիչն
է, Cl+5-ը վերցրել
է էլեկտրոններ,
օքսիդիչը:
բ) Հաշվում
ենք վերականգնիչի
կորցրած և օքսիդիչի
վերցրած էլեկտրոնների
թիվը` նկատի ունենալով
ինդեքսները: Էլեկտրոնների
թիվը կարելի է
հաշվել ինչպես
ըստ ձախ, այնպես
էլ ըստ աջ մասերի,
սակայն ստացված
գործակիցը պետք
է դնել այն մասում,
որի ինդեքսներից
ելնելով էլ հաշվվել
է էլեկտրոնների
թիվը:
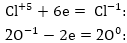
գ) Գտնում
ենք վերցրած և
կորցրած էլեկտրոնների
թվի ամենափոքր
ընդհանուր բազմապատիկը
(6) և բաժանելով էլեկտրոնների
թվին ստանում ենք
հիմնական գործակիցները:
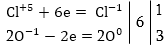
Քանի
որ ամենափոքր ընդհանուր
բազմապատիկը արտադրիչների
վրա բաժանելիս
ստացվում են կրճատված
հակադարձ թվերը,
այստեղից են ծագել
կրճատելու և խաչաձև
գործակիցներ դնելու
կանոնները:
դ)
Ստացված գործակիցները
դնում ենք հավասարման
այն մասում, ըստ
որի ինդեքսների
հաշվել ենք էլեկտրոնների
թիվը (մեր օրինակում
ձախ մասը) և ըստ
այդ գործակիցների
հաշվում ենք մյուս
(աջ) մասի գործակիցները:
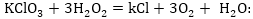
ե) Հաշվում
ենք ջրածնի ատոմների
թիվը (եթե նրանք
կան հավասարման
մեջ) աջ և ձախ մասերում,
և եթե հավասար
չեն պակասող կողմում
ավելացնում ենք
անհրաժեշտ թվով
ջրի մոլեկուլներ:
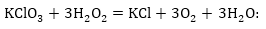
զ) Որպես ստուգում
հաշվում ենք թթվածնի
ատոմների թիվը
ձախ և աջ մասերում:
Ջրածինը հավասարեցնելուց
հետո դրանք պետք
է հավասար լինեն:
2-րդ դեպքում:
Հաճախ
միջմոլեկուլային
օքսիդացման-վհրականգնման
ռեակցիաներում,
օքսիդիչից և վերականգնիչից
բացի, մասնակցում
է ևս մի երրորդ
նյութ (թթու, հիմք,
ջուր) որպես միջավայր:
Հավասարեցումը
կատարվում է հիմնական
դեպքի նման, այն
տարբերությամբ,
որ ջրածինները
հավասարեցնելուց
առաջ, աջ մասից
ելնելով, գտնում
ենք միջավայր նյութի
գործակիցը, որից
հետո հավասարեցնում
ջրածինները:
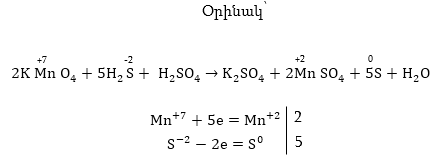
Օքսիդիչ
պերմանգանատից
և վերականգնիչ
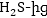 բացի,
այստեղ մասնակցում
է երրորդ նյութ
բացի,
այստեղ մասնակցում
է երրորդ նյութ
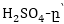 որպես
միջավայր: Հիմնական
գործակիցները
դնելուց և աջ ու
ձախ մասերը հավասարեցնելուց
հետո, ըստ աջ մասի
հաշվում ենք
որպես
միջավայր: Հիմնական
գործակիցները
դնելուց և աջ ու
ձախ մասերը հավասարեցնելուց
հետո, ըստ աջ մասի
հաշվում ենք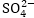 իոնների
թիվը՝ երեք, դնում
ծծմբական թթվին
գործակից, որից
հետո հաշվում ջրի
մոլեկուլների
թիվը:
իոնների
թիվը՝ երեք, դնում
ծծմբական թթվին
գործակից, որից
հետո հաշվում ջրի
մոլեկուլների
թիվը:
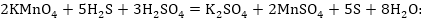
3-րդ
դեպք: Երբեմն միջմոլեկուլային
օքսիդացման-վերականգնման
ռեակցիաներում
վերականգնիչի
կամ օքսիդիչի ոչ
բոլոր մոլեկուլներն
են մասնակցում
օքսիդացման-վերականգնման
պրոցեսին, մի մասը
չի փոխում օքսիդացման
աստիճանը:
Օրինակ՝
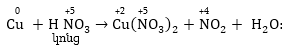
Այստեղ
օքսիդիչ ազոտական
թթվի մոլեկուլների
մի մասը մասնակցել
է օքսիդացման-վերականգնման
պրոցեսին վերածվելով
NO2-ի, մյուս մասը
չի մասնակցել,
առաջացնելով նիտրատ:
Հավասարեցումը
կատարվում է հիմնական
դեպքի նման:
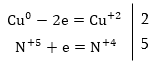
Այն տարբերությամբ,
որ ջրածինները
հավասարեցնելուց
առաջ, ըստ աջ մասի,
հաշվում ենք օքսիդավերականգնման
չմասնակցած 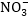 իոնների
թիվը (2) և ավելացնում
HNO3-ի հիմնական
գործակցի վրա,
ոից հետո միայն
հավասարեցնում
ջրածնի ատամների
թիվը.
իոնների
թիվը (2) և ավելացնում
HNO3-ի հիմնական
գործակցի վրա,
ոից հետո միայն
հավասարեցնում
ջրածնի ատամների
թիվը.
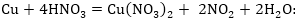
4րդ դեպք: Լինում
են միջմոլեկուլային
օքսիդացման-վերականգման
ռեակցիաներ, որոնցում
կան մեկից ավելի
օքսիդիչներ կամ
վերականգնիչներ:
Օրինակ՝
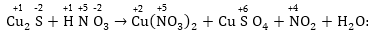
Այստեղ վերականգնիչ
են և Cu+1 - ը, և S-2- ը:
Հավասարեցումը
կատարվում է հիմնական
դեպքի նման, միայն
վերականգնիչների
(կամ օքսիդիչների)
էլեկտրոնների
թվերը գումարվում
են:
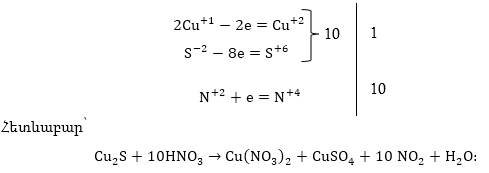
Այս օրինակում
նաև օքսիդիչ HNO3
-ի ոչ բոլոր մոլեկուլներն
են մասնակցել օքսիդացման-վերականգնման
գործընթացին և
չմասնակցածների
թիվը՝ 2-ը պետք է
ավելացնել հիմնական
գործակցին:
II. Ներմոլեկուլային օքսիդացման-վերականգման
ռեկցիաների հավասարումների
կազմումը կատարվում
է՝ ելնելով աջ
մասի ինդեքսներից,
այսինքն էլեկտրոնների
թիվը հաշվվում
է՝ ելնելով աջ
մասից, ստացված
գործակիցները
նախ դրվում են
աջ մասում և ըստ
դրանց հաշվվում
է ձախ մասի գործակիցը:
Օրինակ՝
Այս դեպքում
վերականգնիչ թթվածինը
և օքսիդիչ քլորը
գտնվում են նույն
նյութի մեջ:
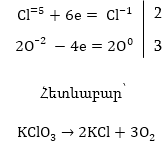
ըստ աջ մասի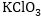 - գործակիցը
կստացվի 2:
- գործակիցը
կստացվի 2:
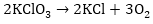
III. Ինքնաօքսիդացման-ինքնավերականգման
ռեկցիաների հավասարումների
կազմումը ևս պետք
է կատարել ըստ
աջ մասի, ստացված
գործակիցները
դնել նախ աջ մասում,
իսկ դրանց գումարը՝
ձախ մասում՝
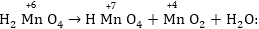
Դրա պատճառն
այն է նրանում,
որ թթվային միջավայրում
լուծույթում եղած
H+ իոնները "խցկվում
են 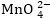 իոնում
Mn+7-ի շրջաւղաաող
O2- մասնիկների
միջև, խարխլում
իոնը և հեշտացնում
Mn+7-ի՝ էլեկտրոններ
վերցնելու գործընթացը,
ուստի վերջինս
վերցնում է առավելագույն
թվով՝ 5 էլեկտրոն:
իոնում
Mn+7-ի շրջաւղաաող
O2- մասնիկների
միջև, խարխլում
իոնը և հեշտացնում
Mn+7-ի՝ էլեկտրոններ
վերցնելու գործընթացը,
ուստի վերջինս
վերցնում է առավելագույն
թվով՝ 5 էլեկտրոն:
Հիմնային
միջավայրում լուծույթում
OH- իոնների առկայությունը,
ընդհակառակը՝
խտացնում է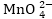 իոնում
Mn+7-ի շուրջը եղած
O2--ների շրջափակումը,
որը դժվարացնում
է Mn+7-ի՝ էլեկտրոններ
վերցնելու գործընթացը,
ուստի վերջինս
վերցնում է նվազագույն
թվով՝մեկ էլեկտրոն:
իոնում
Mn+7-ի շուրջը եղած
O2--ների շրջափակումը,
որը դժվարացնում
է Mn+7-ի՝ էլեկտրոններ
վերցնելու գործընթացը,
ուստի վերջինս
վերցնում է նվազագույն
թվով՝մեկ էլեկտրոն:
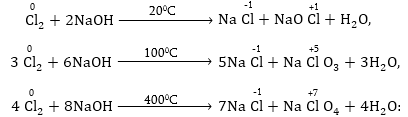
Հաճախ
օքսիդացման-վերականգնման
ռեակցիայի բնույթի
վրա ազդում է նաև
ջերմաստիճանը:
Օրինակ. քլորի
ինքնաօքսիդացման-ինքնավերականգնման
ռեակցիան հիմնային
միջավայրում, կախված
ջերմաստիճանից,
ընթանում է տարբեր
կերպ:
Չափազանց
բարդ է ընթանում
ազոտական թթվի
վերականգնումը:
N+5-ի վերցրած էլեկտրոնների
թիվը կախված է
ոչ միայն վերականգնիչի
բնույթից, այլև
թթվի կոնցենտրացիայից
և ջերմաստիճանից:
>>
8.6. Օքսիդացման
-
վերականգնման
ռեակցիաների հավասարումների
կազմումը
իոնա-էլեկտրոնային
եղանակով
Այս եղանակի
էությունն այն
է նրանում, որ նախ
կազմում են օքսիդացման
և վերականգնման
պրոցեսների, այսպես
կոչված, իոնաէլեկտոոնային
(կիսառեակցիաների)
հավասարումները:
Այդ հավասարումների
և դրանց հիման
վրա օքսիդացման-վերականգնման
ռեւսկցիայի լրիվ
հավասարման կազմումը
կատարվում է մի
քանի փուլերով:
1. Հաշվում
են ռեակցիային
մասնակցող նյութերում
տարրերի օքսիդացման
աստիճանները և
համեմատելով գտնում
օքսիդիչը և վերականգնիչը.
Օրինակ.
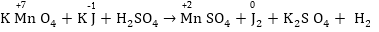
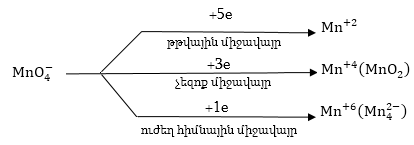
Օքսիդիչը
KMnO4 -ն՝ այսինքն՝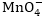 իոնը,
իսկ վերականգնիչը՝
KJ-ը այսինքնJ-իոնը:
իոնը,
իսկ վերականգնիչը՝
KJ-ը այսինքնJ-իոնը:
2. Գրում են
ռեակցիայի կրճատ
իոնամոլեկուլային
սխեման:
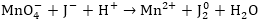
Այստռղից
երևում է, որ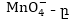 վերականգնվել
է մինչև Mn+2, իսկ
J- օքսիդացել է
մինչև
վերականգնվել
է մինչև Mn+2, իսկ
J- օքսիդացել է
մինչև 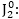
3. Կազմում
են օքսիդացման
վերականգնման
կիսառեակցիաներհ
իոնաէլեկտրոնային
հավասարումները
առանձին-առանձին,
նրանց ձախ և աջ
մասերում յուրաքանչյուր
տարրի ատոմները
հավասարեցվում
են՝ ավելացնելով
յուրաքանչյուր
կիսառեակցիաներին
անհրաժեշտ համապատասխան
նյութեր:
Այսպես՝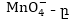 Mn2+-ի
վերականգնման
կիսառեակցիայում
թթվածնի ատոմները
կապելու համար
անհրաժեշտ է H+
իոնների ներկայությունը:
Mn2+-ի
վերականգնման
կիսառեակցիայում
թթվածնի ատոմները
կապելու համար
անհրաժեշտ է H+
իոնների ներկայությունը:
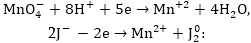
Հավասարման
աջ և ձախ մասերում
լիցքերի, գումարը
հավասարեցնելու
համար, ձախ մասում
ավելացվում և հանվում
են անհրաժեշտ թվով
էլեկտրոններ:
4. Գտնում
են այդ կորցրած
և ընդունած էլեկտրոնների
թվերի ամենափոքր
ընդհանուր բազմապատիկը
և բաժանելով էլեկտրոնների
թվերին, ստացված
թվերով բազմապատկում
են կիսառեակցիաների
հավասարումները:
Այդ դեպքում վերականգնիչի
կորցրած և օքսիդիչի
վերցրած
էլեկտրոնների
թվերը հավասարվում
են.
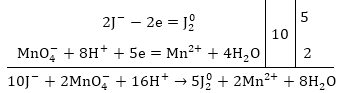
5. Ստացված
գործակիցները
դրվում են հիմնական
հավասարման մեջ
համապատասխան
նյութերի համար:
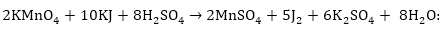
Իոնաէլեկտրոնային
եղանակի առավելությունն
այն է, որ չի օգտագործվում
օքսիդացման աստիճանի
ձևական հասկացությունը,
որը հաճախ չի արտահայտում
պրոցեսի էությունը:
>>
9. էլեկտրաքիմիա
էլեկտրաքիմիան ուսումնասիրում
է էլեկտրական հոսանքի
առաջացումով ուղեկցվող,
ինչպես նաև էլեկտրական
հոսանքի ծախսման
հաշվին ընթացող
օքսիդացման-վերականգման
քիմիական պրոցեսները:
Առաջին դեպքում
տեղի է ունենում
քիմիական էներգիայի
փոխարկում էլեկտրականի՝
օրինակ, գալվանական,
վառելիքային էլեմենտներում,
երկրորդ դեպքում
էլեկտրական էներգիայի
փոխարկում քիմիականի՝օրինակ,
էլեկտրոլիզի պրոցեսում:
>>
9.1. Գալվանական
էլեմենտների տեսություն
Ցանկացած
ինքնաբերաբար
ընթացող օքսիդացման-վերականգնման
ռեակցիայում տեղի
է ունենում էլեկտրոնների
անցում վերականգնիչից՝
օքսիդիչին: Օրինակ՝
մետաղական ցինկը
պղնձի սուլֆատի
լուծույթի մեջ
ընկղմելիս տեղի
է ունենում պղնձի
արտամղման օքսիդացման
- վերականգնման
ռեակցիա.
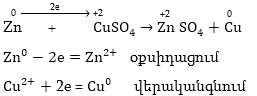
էլեկտրոնների
անցումը ցինկից
պղնձի տեղի է ունենում
մետաղական ցինկի
լուծույթի շփման
սահմանում:
Եթե օքսիդացման
և վերականգնման
այդ կիսառեակցիաները
տարածականորեն
բաժանենք իրաից,
և էլեկտրոնների
անցումը ցինկից
պղնձի իրականացնենք
հաղորդալարերի
միջով, կստանանք
էլեկտրոնների
ուղղորդված շարժում,
այսինքն՝ էլեկտրական
հոսանք:
Այդպիսի
սարքերը, որոնցում
ինքնաբերաբար
ընթացող օքսիդացման-վերականգնման
ռեակցիայից ստացվում
է էլեկտրական էներգիա,
կոչվում են գալվանական
էլեմենտներ:
>>
9.1.1. էլեկտրոդային
պոտենցիալ
Ընկղմենք
մետաղե թիթեղը
իր իոնները պարունակող
լուծույթի մեջ:
Մետաղի բյուրեղային
ցանցի հանգույցներում
գտնվում են մետաղի
ատոմներ,
իոններ և դրաեցից
պոկված էլեկտրոններ,
որոնց միջև գոյություն
ունի հավասարակշռություն.
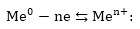
Ջրի բևեռային
մոլեկուլները
կողմնորոշվում
են մետաղի մակերեսին
գտնվող իոնների
նկատմամբ և ձգվում
են իրենց բացասական
բևեռներով: Դրա
հետևանքով մետաղի
իոնի կապը բյուրեղի
հետ թուլանում
է ջրի դիէլեկտրիկ
թափանցելիության
չափով՝ s=81, ութսունմեկ
անգամ, իոնը դառնում
է շարժուն և ջերմային
հարվածների շնորհիվ
կարող է դուրս
գալ մետաղից՝ էլեկտրոնները
թողնելով մետաղի
մեջ.
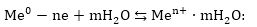
Պարզության
համար հիդոատացնող
ջուրը հավասարման
մեջ չի գրվում:
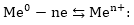
Մետաղի
թիթեղը էլեկտրոնների
գոյացած ավելցուկի
շնորհիվ կլիցքավորվի
բացասականապես,
իսկ լուծույթը՝
մետաղի իոննների
ավելցուկի հետևանքով
դրականապես:
Լուծույթի
մեջ անցած դրական
իրոնները կարող
են ձգվել բացասական
լիցքավորված թիթեղի
կողմից և վերադառնալ,
ուստի պրոցեսը
կլինի դարձելի
և կհասնի շարժուն
հավասարակշռության
վիճակի:
Մետաղի
հիդրատացված իոնները
բացասական լիցքավորված
թիթեղի էլեկտրաստատիկ
ձգողության շնորհիվ
հեռու չեն գնում
թիթեղի մակերեսից,
և մետաղ-լուծույթ
սահմանում առաջանում
է կրկնակի էլեկտրական
շերտ (նկ. 9.1),որոշոկի
պոտենցիալների
տարբերությամբ:
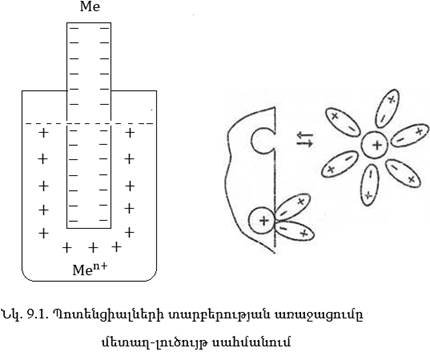
Պոտենցիալների
այն տարբերությունը,
որն առաջանում
է մետաղի թիթեղի
և իր իոնները պարունակող
լուծույթի միջև
հավասարակշռության
վիճակում կոչվում
է էկենտոոոային
աոտենցիալ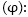
Իր իոնը
պարունակող լուծույթի
մեջ ընկղմված մետաղի
թիթեղը կոչվում
է էլեկտրոդ, էլեկտրոդը
լուծույթի հետ
մհասին՝ կիսաէլեմենտ:
Էլեկտրոդային
պոտենցիալը, փաստորեն,
այն աշխատանքն
է (A), որն անհրաժեշտ
է կատարել միավոր
լիցքը էլեկտրոդից
լուծույթ տեղափոխելու
համար:
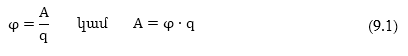
>>
9.1.2. էլեկտրոդային
պրոցեսների թերմոդինամիկան
Քննարկենք
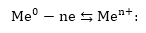
պրոցեսի
թերմոդինամիկան:
Men+ մեկ իոնը թիթեղից
լուծույթ տեղաւիոխելու
աշխատանքը՝

Մեկ մոլ
Men+իոններ լուծույթ
տեղափոխելու աշխատանքը
կլինի

Մեկ մոլ
էլեկտրոնների
լիցքը նշանակվում
է F տառով և կոչվում
է Ֆարադեյի թիվ:
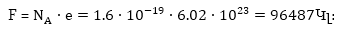
ՈՒստի

Մյուս
կողմից թերմոդինամիկայից
հայտնի է, որ առավելագույն
օգտակար աշխատանքը
հավասար է Գիբսի
էներգիայի փոփոխությանը
(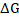 ) հակառակ
նշանով:
) հակառակ
նշանով:

Ուստի (9.4) ից

Հետևաբար,
եթե հայտնի է Գիբսի
էներգիայի փոփոխությունը,
ապա կարելի է հաշվել
էլեկտրոդային
պոտենցիալը: Քննարկվող պրոցեսի
համար Գիբսի էներգիայի
փոփոխությունը
կապված է ելանյութերի
և վերջնանյութերի
ակտիվության հետ
հետևյալ բանաձևով:
պրոցեսի
համար Գիբսի էներգիայի
փոփոխությունը
կապված է ելանյութերի
և վերջնանյութերի
ակտիվության հետ
հետևյալ բանաձևով:

որտեղ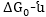 Գիբսի
էներգիայի ստանդարտ
փոփոխությունն
է: Տեղագրելով
Գիբսի
էներգիայի ստանդարտ
փոփոխությունն
է: Տեղագրելով
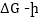 արժեքը
(9.6) հավասարման մեջ
կստանանք
արժեքը
(9.6) հավասարման մեջ
կստանանք
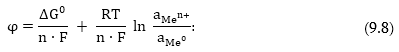
Քանի որ ռեկցիային
մասնակցող պինդ
նյութերի ակտիվությունը
հավասար է մեկի,
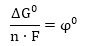
իսկ նոսր
լուծույթների
համար իոնների
ակտիվությունը
քիչ է տարբերվում
կոնցենտրացիայից
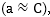 կստանանք`
կստանանք`
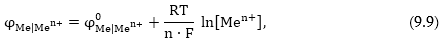
որտեղ
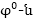 ստանդարտ
էլեկտրոդային
պոտենցիալն է,
R-ը՝ գազային ունիվերսալ
հաստատունը, T-ն՝
բացարձակ ջերմաստիճանը,
ո-ը՝ իոնի լիցքը,
ստանդարտ
էլեկտրոդային
պոտենցիալն է,
R-ը՝ գազային ունիվերսալ
հաստատունը, T-ն՝
բացարձակ ջերմաստիճանը,
ո-ը՝ իոնի լիցքը,
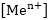 - մետաղի
իոնների կոնցենտրացիան:
- մետաղի
իոնների կոնցենտրացիան:
Այս հավասարումը
կոչվում է Ներնստի
հավասարում: Այն
կապ է հաստատում
էլեկտրոդային
պոտենցիալի, ստանդարտ
էլեկտրոդային
պոտենցիալի մետաղի
իոնների կոնցենտրացիայի
և ջերմաստիճանի
միջև:
Ստանդարտ
(կամ նորմալ) էլեկտրոդային
պոտենցիալը, պոտենցիալների
այն տարբերությունն
է, որն առաջանում
է մետաղի թիթեղի
և իր իոնների մեկ
մոլ/լիտր
կոնցենտրացիա
(ակտիվություն)
ունեցող լուծույթի
միջև ստանդարտ
պայմաններում:
Ստանդարտ
պայմաններ են
T= 298K, P =101.3կՊա =1մթն:
Ստանդարտ
էլեկտրոդային
պոտենցիալը կախված
չէ իոնների կոնցենտրացիայից
և ջերմաստիճանից:
Այն կախված է մետաղի
բնույթից և տվյալ
մետաղի համար հաստատուն
բնութագրական
մեծություն է:
Եթե Ներնստի
հավասարման մեջ
տեղադրենք հաստատունների
արժեքները, ջերմաստիճանն
ընդունենք 25°C (298K) և
բնական լոգարիթմը
փոխարինենք տասնորդականով՝
հավասարումը կընդունի
հետևյալ՝ հաշվարկների
համար ավելի հարմար
տեսքը.
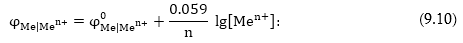
Օրինակ
9.1. Հաշվել ցինկի
էլեկտրոդի էլեկտրոդային
պոտենցիալը, եթե
լուծույթում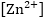 իոնների կոնցենտրացիան
0.01մոլ/լ է:
իոնների կոնցենտրացիան
0.01մոլ/լ է:
Լուծում
ցինկի էլեկտրոդի
ստանդարտ էլեկտրոդային
պոտենցիալը
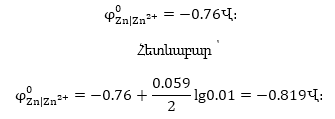
>>
9.1.3. Դանիել
- Յակոբիի գալվանական
էլեմենտը
Դանիել
- Յակոբիի գալվանական
էլեմենտը կազմված
է ցինկի և պղնձի
էլեկտրոդներից,
որոնք ընկղմված
են իրենց սուլֆատների
լուծույթների
մեջ: Օքսիդիչի(Cu2+)
և վերականգնիչի
(Zn0) ուղղակի փոխազդեցությունից
խուսափելու համար
լուծույթները
բաժանված են ծակոտկեն
միջնորմով: Առաջին
կիսաէլեմենտում
վերը նշված մեխանիզմով
ցինկի թիթեղից
ցինկ իոններն անցնում
են լուծույթի մեջ՝
Zn0 - 2e = Zn2+, թիթեղը
լիցքավորվում
է բացասկան, լուծուլթը՝
դրական լիցքով,
հաստատվում է հավասարակշռություն,
և առաջանում է
որոշակի պոտենցիալների
տարբերություն:
Պղնձի
կիսաէլեմենտում
նույնպես էլեկտրոդի
լուծույթի միջև
առաջանում է կրկնակի
էլեկտրոդային
շերտ, և հաստատուն
է հավասարակշռություն
 որոշակի
պոտենցիալների
տարբերությամբ:
որոշակի
պոտենցիալների
տարբերությամբ:
Սակայն
քանի որ պղինձն
ավելի պասիվ մետաղ
է, քան ցինկը, վերջինիս
էլեկտրոդային
պոտենցիալն ավելի
բացասական կլինի,
քան պղնձինը, ուստի
եթե շղթան փակենք,
այսինքն՝ միացնենք
ցինկի և պղնձի
էլեկտրոդները
հաղորդալարով,
ապա պոտենցիալների
տարբերության
շնորհիվ էլեկտրոնները
ցինկի էլեկտրոդից
կանցնեն պղնձի
մեջ: Կառաջանա
էլեկտրոնների
ուղղված շարժում,
այսինքն՝ հաստատուն
հոսանք: Առաջանում
է Zn-Cu գալվանական
էլեմնենտ (նկ. 9.2):
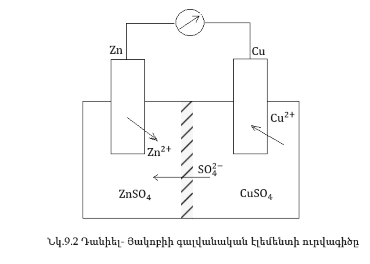
Որքան
ավելի դրական արժեք
ունի մետաղի ստանդարտ
էլեկտրոդային
պոտենցիալը, այնքան
ավելի ուժեղ օքսիդիչ
է մետաղի իոնը,
այսինքն՝ ավելի
հեշտությամբ է
ձեռք բերում էլեկտրոն:
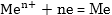
Օրինակ,
հայտնի է, որ արծաթի
և ոսկու իոնները
ուժեղ օքսիդիչներ
են, որի շնորհիվ
ոչնչացնում են
մանրէներին: Շարքի
հիմնական օրինաչափությունից
հետևում է, որ
1. Շարքում
յուրաքանչյուր
մետաղ դուրս է
մղում իրենից հետո
կանգնած մետաղներին
իրենց աղերի ջրային
լուծույթներից՝
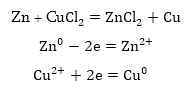
Ասվածը
ալկալիական և հողալկալիական
մետաղներին չի
վերաբերում, քանի
որ դրանք փոխազդում
ես ոչ թե աղի, այլ
ջրի հետ:
2. Շարքում
ջրածնից առաջ կանգնած
մետաղները դուրս
են մղում ջրածին
թթուների լուծութներից:
Մինչև մագնեզիում
գտնվող մետաղները
սովորական ջերմաստիճանում
ջրածին դուրս են
մղում նաև ջրից.
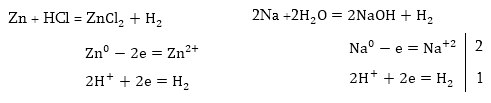
Դա նշանակում
է, որ ջրածնից հետո
կանգնած
մետաղները իրենք
դուրս կմղվեն ջրածնի
կողմից՝
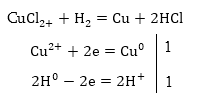
Քանի որ
չեզոք ջրային լուծույթներում
ջրածնի իոնի կոնցենտրացիան
10-7 մոլ/լ է, ապա 2H+
+ 2e =H2 պրոցեսի պոտենցիալը
ջրային լուծույթում
ստանդարտ պայմաններում
կլինի.
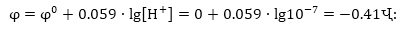
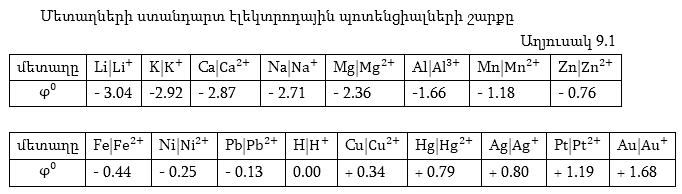
Այդ պատճառով
շարքում - 0.41 Վ -ից
ավելի բացասական
պոտենցիալ ունեցող
մետաղները ջրից
կարող են դուրս
մղել ջրածին:
3. Որքան
հեռու են իրարից
մետաղները լարվածության
շարքում, այնքան
մեծ կլինի դրանցից
կազմված գալվանական
էլեմենտի էլշ-ուն:
Որոշ մետաղների
դիրքերը լարվածության
շարքում և պարբերական
համանակարգում
չեն համապատասխանում
իրար, օրինակ՝
ըստ պարբերական
համակարգի Li-ը Na-ից
և K-ից պետք է պասիվ
լինի, մինչդեռ
լարվածության
շարքում ավելի
առաջ է: Պատճառը
հետևյալն է. ինչպես
արդեն ասվել է
էլեկտրոդային
պոտենցիալը այն
աշխատանքն
է, որն անհրաժեշտ
է պինդ մետաղում
գտնվող ատոմները
փոխարկելու ջրային
լուծույթներում
գտնվող հիդրատացված
իոնների: Այդ աշխատանքը
հավասար է իզոբար-իզոթերմ
պոտենցիալի տարբերությանը՝
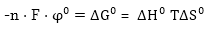
Սենյակային
ջերմաստիճանում,
լուծույթում ընթացող
պրոցեսների համար
էնտրոպիայի փոփոխությունը
մեծ չէ, և 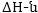 շատ
մեծ է
շատ
մեծ է 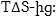 Այդ
պատճառով էլ կարելի
է ընդունել, որ
Այդ
պատճառով էլ կարելի
է ընդունել, որ
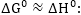 Հետևաբար
Հետևաբար
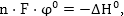 որտեղից
որտեղից

Այսպիսով
էլեկտրոդային
պոտենցիալի մեծությունը
որոշվում է էնթալպիայի
փոփոխությամբ:
էլեկտրոդային
պրոցեսի էսթալպիսդի
փոփոխությունը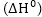 կազմված
է երեք բաղադրամասերից:
կազմված
է երեք բաղադրամասերից:
Առաջին՝
մետաղի բյուրեղը
մեկուսացված ատոմների
տրոհելու աշխատանքն
է՝ ատոմացման
էներգիան:

Երկրորդ՝
չեզոք ատոմներից
վալեստական էլեկտրոների
պոկման, այսինքն՝
իոնացման
էներգիանէ:
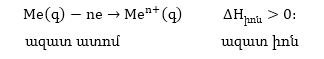
Երրորդ՝
լուծույթ տեղափոխված
իոնների հիդրատացման
էներգիանէ:
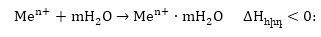
Բյուրեղային
ցանցի քայքայումը
ատոմների և ատոմների
վերածումը իոնների
պահանջում է էներգիայի
ծախս՝ 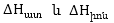 մեծ
են զրոյից: Իոնների
հիդրատացումը,
ընդհակառակը, ընթանում
է էներգիայի անջատումով՝
մեծ
են զրոյից: Իոնների
հիդրատացումը,
ընդհակառակը, ընթանում
է էներգիայի անջատումով՝
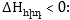 Գումարային
էներգետիկ էֆեկտը
հավասար է դրանց
հանրահաշվական
գումարին
Գումարային
էներգետիկ էֆեկտը
հավասար է դրանց
հանրահաշվական
գումարին
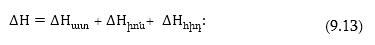
Ատոմացման
էներգիան կախված
է մետաղի բյուրեղային
ցանցի ամրությունից:
Իոնացման էներգիան
որոշվում է պարբերական
համակարգում մետաղի
մետաղի գրաված
դիրքով: Հիդրատացման
ժամանակ անջատված
էներգիան կախված
է իոնի կառուցվածքից,
լիցքից և շառավղից:
Li+ -ը և
Na+-ն ունեն միևնույն
լիցքը, սակայն
լիթիումի իոնը,
շնորհիվ փոքր շառավղի,
ավելի ուժեղ է
ձգում ջրի բևեռային
մոլեկուլներիս,
քան նատրիումի
իոնը և հիդրատացման
ժամանակ զգալիորեն
ավելի շատ էներգիա
է անջատվում: Դրա
հետևանքով լիթիումի
համար էներգիայի
գումարային ծախսն
ավելի փոքր է ստացվում,
քան նատրիումի
համար, և այդ պատճառով
լարվածության
շարքում լիթիումը
դասավորվում է
ավելի առաջ, քան
նատրիումը:
Պղնձի
և ցինկի ազատ ատամների
իոնացման, իոնների
հիդրատացման էներգիաները
համարյա հավասար
են, սակայն մետաղական
պղինձն առաջացնում
է ավելի ամուր
բյուրեղային ցանց,
քան ցինկը: Դա երևում
է նաև այդ մետաղների
հալման ջերմաստիճաններից:
Ցինկը հալվում
է 419.5, իսկ պղինձը՝
1083 0C-ում: Այդ պատճառով
պղնձի ատոմացման
էներգիան զգալիորեն
ավելի մեծ է ցինկի
ատոմացման էներգիայից
(339 և 130 կՋ/մոլ համապատասխանաբար),
ուստի ամբողջ պրոցեսի
գումարային էներգիան
ցինկի համար ստացվում
է ավելի փոքր, քան
պղնձի համար, և
լարվածության
շարքում ցինկը
դասավորվում է
ավելի առաջ, քան
պղինձը:
Այսպիսով
պարբերական համակարգը
որոշում է մետաղի
մեկուսացված ատոմի
վերականգնիչ ակտիվությունը,
լարվածության
շարքը՝ բյուրեղային
մետաղի վերականգնիչ
ակտիվությունը
ջրային լուծույթում
250C-ում մետաղի
իոնների միավոր
կոնցենտրացիայի
(ակտիվության)
դեպքում: Այո երկու
վերականգնիչ ակտիվությունները
կարող են որոշ
մետաղների դեպքում
համընկնել, (օրինակ՝
K-Na) և չհամընկնել,
(օրինակ՝ Li-Na,Zn-Cu):
>>
9.1.7. Օքսիդացման
վերականգնման
ռեակցիաների ընթացքի
ուղղության որոշումը
Օքսիդացման-վերականգնման
ռեակցիաների ինքնաբերաբար
ընթանալու ուղղությունը
որոշվում է ելնելով
օքսիդացման-վերականգնման
պոտենցիալների
մեծությունից:
Այդ պոտենցիալը
կախված է իոնների
օքսիդացված և վերականգնված
ձևերի ակտիվությունից
(կոնցենտրացիայից)
և որոշվում է Ներնստի
հավասարումով.
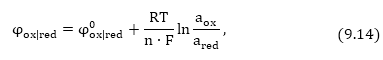
որտեղ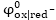 օքսիդավերականգնման
ստանդարտ պոտենցիալն
է, որը բնութագրում
է պոտենցիալի կախումը
օքսիդիչի և վերականգնիչի
բնույթից, ո -ը պրոցեսին
մասնակցող էլեկտրոնների
թիվն է,
օքսիդավերականգնման
ստանդարտ պոտենցիալն
է, որը բնութագրում
է պոտենցիալի կախումը
օքսիդիչի և վերականգնիչի
բնույթից, ո -ը պրոցեսին
մասնակցող էլեկտրոնների
թիվն է,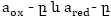 համապատասխանաբար
իոնների օքսիդացած
և վերականգնված
ձևերի կոնցենտրացիանեն
են: Երբ,
համապատասխանաբար
իոնների օքսիդացած
և վերականգնված
ձևերի կոնցենտրացիանեն
են: Երբ, 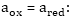

Ինչպես
ցանկացած քիմիական
ռեակցիայի դեպքում,
այս դեպքում ևս
ռեակցիան ընթանում
է ինքնաբերաբար,
եթե ռեակցիայի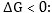 Քանի
որ
Քանի
որ
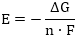
ապա օքսիդացման-վերականգնման
ռեակցիան ինքնաբերաբար
կընթանա, եթե 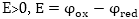 նշանակում
է
նշանակում
է 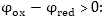 Ուստի
օքսիդացման-վերականգնման
ռեակցիան կարող
է ընթանալ ինքնաբերաբար
այն ուղղությամբ,
որի դեպքում պոտենցիալն
ավելի բարձր արժեք
ունեցող համակարգը
հանդես կգա որպես
օքսիդիչ, այսինքն՝
էլեկտրոնները
կանցնեն ցածր պոտենցիալ
ունեցող համակարգից
բարձրին:
Ուստի
օքսիդացման-վերականգնման
ռեակցիան կարող
է ընթանալ ինքնաբերաբար
այն ուղղությամբ,
որի դեպքում պոտենցիալն
ավելի բարձր արժեք
ունեցող համակարգը
հանդես կգա որպես
օքսիդիչ, այսինքն՝
էլեկտրոնները
կանցնեն ցածր պոտենցիալ
ունեցող համակարգից
բարձրին:
Օրինակ,
ելնելով օքսիդավերականգնման
պոտենցիալների
արժեքներից՝ որոշենք,
թե որ կողմ կընթանա
FeCl3 - ի և հալոգենիդների
միջև ռեակցիաները.
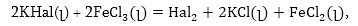
որտեղ Hal-ը
կարող է լինել
F,
Cl, Br, J:
Հնարավոր
պրոցեսների օքսիդավերականգնման
պոտենցիալներն
են՝
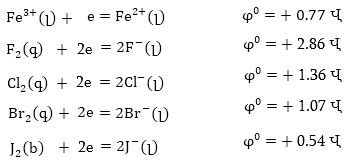
Որոնվող
ռեակցիան իոնական
տեսքով կլինի՝
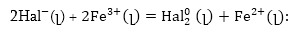
Այդ ռեակցիաներում
ենթադրվող օքսիդիչը
Fe3+ իոնն է, և քանի
որ ինչպես նշվել
է, էլեկտրոնները
ինքնաբերաբար
անցնում են ավելի
փոքր էլեկտրոդային
պոտենցիալ ունեցող
համակարգից ավելի
մեծ ունեցողին, ապա
այդ ռեակցիաները
էլեկտրոդային
պոտենցիալների
տարբերությունը
(էլշու-ն) կլինի
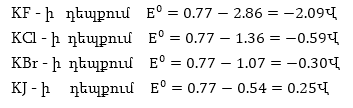
Ստացվեց,
որ էլեկտրոդային
պոտենցիալների
տարբերությունը
դրական արժեք ունի
միայն KJ - ի դեպքում,
և միայն այդ դեպքում
ռեակցիան կգնա
ձախից աջ, և Fe3+ իոնը
կվերականգնվի
Fe2+ -ի:
Այսպիսով,
օքսիդա-վերականգնման
ռեակցիայի ընթացքի
ուղղությունը
որոշելու համար
ենթադրվող օքսիդիչի
պոտենցիալից պետք
է հանել ենթադրվող
վերականգնիչի
պոտենցիալը, այսինքն՝
հաշվել էլշու-ն,
եթե այն մեծ ստացվի
զրոյից, նշանակում
է այդ ռեակցիան
ինքնաբերաբար
կընթանա:
Օրինակ 9.3. ինքնաբերաբար
կընթանա՞ հետևյալ
ռեակցիան
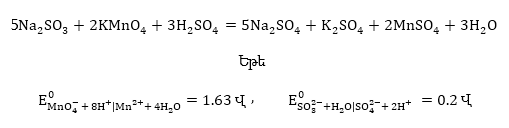
Լուծում.
Գրենք հավասարումը
իոնա-մոլեկուլային
տեսքով.
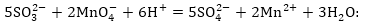
Այստեղ
ենթադրվում է,
որ 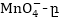 օքսիդիչն
է, իսկ
օքսիդիչն
է, իսկ 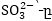 վերականգնիչը,
ուստի
վերականգնիչը,
ուստի
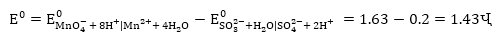
որը մեծ
է զրոյից:
Հետևաբար
այդ ռեակցիան ինքնաբերաբար
կընթանա ձախից
աջ:
>>
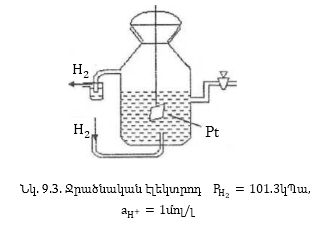
9.2.էլեկտրոլիզ
9.2.1. Ընդհանուր
հասկացություններ
էլեկտրոլիզ
է կոչվում օքսիդացման
վերականգնման
ռեակցիան, որը
ստիպողաբար ընթանում
է արտաքին աղբյուրից
տրվող էլեկտրական
հոսանքի ազդեցության
տակ: Էլեկտրոլիզի
պրոցեսը իրականացնելու
համար անհրաժեշտ
է ունենալ սարք՝
էլեկտրոլիտիկ
բջիջ:
Էլեկտրոլիտիկ
բջիջը (նկ. 9.4) կազմված
է հիմնականում
էլեկտրոլիտիկ
ավազանից (1), էլեկտրոդներից
(2) և հաստատուն հոսանքի
աղբյուրից (3):
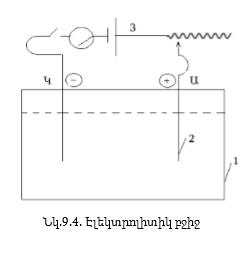
Այն էլեկտրոդը,
որը միացված է
հոսանքի աղբյուրի
բացասական բևեռին,
կոչվում է կատոդ,
իսկ դրական բևեռին
միացվածը՝ անոդ:
Կախված այն բանից,
թե ինչ նյութից
է պատրաստված անոդը,
էլեկտրոլիզը լինում
է երկու տեսակի
1) Չլուծվող
կամ պասիվ անոդով էլեկտրոլիզ,
երբ անոդը պատրաստված
է պրոցեսի համար
իներտ նյութից
(գրաֆիտ, պլատին):
2) Լուծվող
կամ
ակտիվ
անոդով
էլեկտրոլիզ, երբ
անոդը պատրաստված
է այնպիսի մետաղից,
որը էլեկտրոլիզի
պրոցեսում օքսիդանում
է և իոններ է ուղարկում
լուծույթ կամ հալույթ,
լուծվում է:
>>
9.2.2. Անոդային
օքսիդացում և կատոդային
վերականգնում
Քննարկենք
նախ չլուծվող անոդով
էլեկտրոլիզը, երբ
էլեկտրոդները
պատրաստված են
գրաֆիտից:
Ենթադրենք,
որ էլեկտրոլիտիկ
ավազանում կերակրի
աղը հալույթ է:
Հալելիս կերակրի
աղը ենթարկվում
է ջերմաքիմիական
դիսոցման.
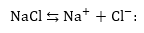
Գոյացած
իոնները հալույթում
կատարում են քաոսային
շարժում: Հոսանքը
միացնելիս դրանք
ստանում են ուղղորդված
շարժում: Նատրիումի
կատիոնները ձգվում
են դեպի կատոդը
և վերցնելով էլեկտրոններ՝
վերականգնվում
ես չեզոք ատոմների,
իսկ քլորիդ իոնները
ձգվելով դեպի անոդը՝
օքսիդանում են
նրա վրա՝ վերածվելով
չեզոք ատոմների
և կազմելով մոլեկուլներ:
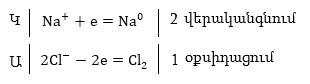
Հետևաբար
էլեկտրոլիզի պրոցեսում
տեղի է ունենում
կատոդային վերականգնում
և անոդային օքսիդացում,
այսինքն օքսիդւսցման-
վերականգնմւսն
ռեակցիա: Գումարային
հավասարումը կլինի
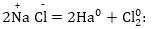
էլեկտրոդների
վրա անջատված նյութերը
կոչվում են էլեկտրոլիզի
հիմնական
արգասիքներ:
Երբեմն, լուծույթների
էլեկտրոլիզի դեպքում,
այդ նյութերը փոխազդում
են լուծույթում
մնացած նյութերի
հետ առաջացնելով
էլեկտրոլիզի երկրորդական
արգասիքներ:
>>
9.2.3. Իոնների
լիցքաքթափման
հաջորդականությունը
էլեկտրոլիզի ժամանակ
էլեկտրոլիտների
լուծույթներում,
երբեմն նաև հալույթներում,
պարունակվում
են մեկից ավելի
տեսակի կատիոններ
և մեկից ավելի
տեսակի անիոններ:
Հետևաբար առաջանում
է խնդիր, թե նույնանուն
լիցք ունեցող տարբեր
տեսակի իոնները
միաժամանա՞կ կլիցքաթափվեն
համապատասխան
էլեկտրոդի վրա,
թե՞ հաջորդաբար,
եթե հաջորդաբար,
ապա ինչպիսի հերթականությամբ:
1. Կատիոնների
լիցքաթափումը
Որպեսզի
կատիոնը լիցքաթափվի,պետք
է վերցնի էլեկտրոն:
Քանի որ տարբեր
մետաղների կատիոնների
էլեկտրոն վերցնելու
հատկությունը
նույնը չէ, ապա
դրանք միաժամանակ
չեն լիցքաթափվի:
Առաջին հերթին
էլեկտրոն կվերցնի
այն կատիոնը, որը
հեշտ է վերցնում,
իսկ այդպիսին կլինի
առավել պասիվ մետաղի
կատիոնը: Նշանակում
է լիցքաթափումը
պետք է կատարվի
լարվածության
շարքի հակառակ
ուղղությամբ, իսկ
դա նշանակում է,
որ առաջին հերթին
պետք է լիցքաթափվի
այս մետաղի կատիոնը,
որի ստանդարտ էլեկտրոդային
պոտենցիալը ավելի
մեծ է:
Այս օրինաչափությունը
պահպանվում է հալույթների
էլեկտրոլիզի դեպքում
(§ 9.1.6.) ջրածնի իոնների
վերականգնման
պոտենցիալը չեզոք
լուծույթից (PH=7) ունի
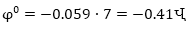
արժեք, ուստի
այն մետաղները,
որոնց էլեկտրոդային
պոտենցիալը ավելի
դրական է, քան -0.41
Վ - ը, դրանց կատիոնները
կանջատվեն ջրածնից
առաջ:
Դրանք են
լարվածության
շարքում երկաթից
մինչև ջրածին ընկած
մետաղները: Այն
մետաղները, որոնց
պոտենցիալը մոտ
է - 0.41 Վ -ի, կախված էլեկտրոլիզի
պայմաններից և
լուծույթի կոնցենտրացիայից
հնարավոր է, ինչպես
մետաղի վերականգնում,
այնպես էլ ջրածնի
անջատում: Այդպիսիք
են լարվածության
շարքում մինչև
ալյումինիում
ընկած մետաղները:
Անիոնների
լիցքաթափման դեպքում
ևս առաջին հերթին
իրականանում է
էներգետիկ տեսակետից
ամենից ձեռնտու
պրոցեսը: Առաջին
հերթին լիցքաթափվում
են պարզ անիոնները
Cl- ,Br- ,S2- այնուհետև
OH- իոնները (ջրի
բևեռային մոլեկուլները),
որից հետո միայն
բարդ անիոնները՝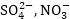 և
այլն: Օրինակ Cl2-
2e = 2Cl- պրոցեսի, մինչդեռ
և
այլն: Օրինակ Cl2-
2e = 2Cl- պրոցեսի, մինչդեռ
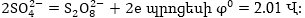
>>
9.2.4. Չլուծվող
անոդով էլեկտրոլիզի
օրինակներ
Իմանալով
իոնների լիցքաթափման
հաջորդականությունը՝
հնարավոր է գրել
ցանկացած աղի կամ
աղերի խառնուրդի
ջրային լուծույթի
կամ հալույթի էլեկտրոլիզի
հավասարումները,
պարզել անջատված
նյութերը:
1. Նատրիումի
քլորիդի ջրային
լուծույթի էլեկտրոլիզ:
Ջրային լուծույթում
NaCl-ը դիսոցվում է՝
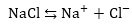
Համաձայն
կատիոնների լիցքաթափման
հաջորդականության՝
կատոդի վրա կանջատվի
ջրածնի իոնը: Ջրային
լուծույթներում
H+ իոնների կոնցենտրացիան
շատ փոքր է (10-7 մոլ/լ),
և ջրածինը անջատվում
է կատոդի վրա ջրի
բևեռային մոլեկուլների
վերականգնման
հաշվին: Անոդի
վրա կօքսիդանան
Cl- իոնները.
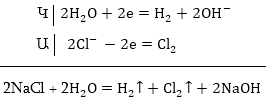
Լուծույթում
կմնա NaOH: Եթե Էլեկտրոլիտիկ
բջջում կատոդային
և անոդային տարածությունները
անջատված չեն,
քլոր գազը լուծույթից
դուրս գալիս կփոխազդի
գոյացած նատրիումի
հիդրօքսիդի հետ
սենյակի ջերմաստիճանում՝
առաջացնելով Ժավելյան
ջուր
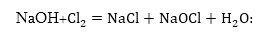
2.Կալիումի
սուլֆտի ջրային
լուծույթի էլեկտրոլիզ
Համաձայն
իոնների լիցքաթափման
հաջորդականության՝
այս դեպքում K+
և H+ իոններից կլիցքաթափվի
ջրածինը, իսկ 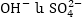 իոններից՝OH--ը,
և կատոդի, և անոդի
վրա համապատասխանաբար
կվերակնգնվեն
և կօքսիդանան ջրի
բևեռային մոլեկուլները:
իոններից՝OH--ը,
և կատոդի, և անոդի
վրա համապատասխանաբար
կվերակնգնվեն
և կօքսիդանան ջրի
բևեռային մոլեկուլները:
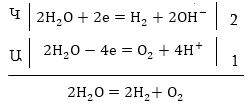
Արդյունքում
էլեկարոլիզի կենթարկվի
ջուրը, կատոդի
մոտ կկուտակվի
ալկալի, անոդի
մոտ՝ թթու:
3. Պղնձի սուլֆատի
ջրային լուծույթի
էլեկտրոլիզ
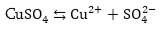
Կատոդի վրա
կլիցքաթափվի ջրածնից
ավելի մեծ էլեկտրոդային
պոտենցիալ ունեցող
պղինձը, իսկ անոդի
վրա կօքսիդանան
ջրի մոլեկուլները
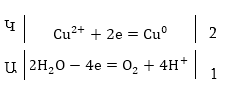
Գումարային
հավասարումը.
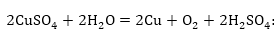
>>
9.2.5 Քայմանան
պոտենցիալ
Քննարկենք
այն հարցը, թե տվյալ
էլեկտրոլիտը էլեկտրոլիգի
ենթարկելու համար
արդյո՞ք բավական
է ունենալ զրոյից
տարբեր լարում
ունեցող հաստատուն
հոսանքի աղբյուր,
թե յուրաքանչյուր
էլեկտրոլիտ պահանջում
է որոշակի նվազագույն
լարում, որի դեպքում
միայն կենթարկվի
էլեկտրոլիզի: Ենթադրենք
էլեկտրոլիզի է
ենթարկվում աղաթթուն
իներտ (չլուծվող)
էլեկտրոդներով
(նկ.9.4): Կատոդի վրա՝
տեղի կունենա ջրածնի
անջատում, անոդի
վրա քլորի:
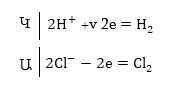
Կատոդի
մակերեսը կպատվի
գազային ջրածնով,
և այն կվերածվի
ջրածնական էլեկտրոդի՝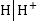 ,անոդի
մակերեսը՝ քլորով,
և այն
,անոդի
մակերեսը՝ քլորով,
և այն
կվերածվի
քլորային էլեկտրոդի՝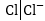 : Քանի
որ այս էլեկտրոդները
իրար միացված են,
կառաջանա ջրածնա-քլորային
գալվանական էլեմենտ
: Քանի
որ այս էլեկտրոդները
իրար միացված են,
կառաջանա ջրածնա-քլորային
գալվանական էլեմենտ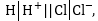 որի
էլեկտրաշարժ ուժը
որի
էլեկտրաշարժ ուժը
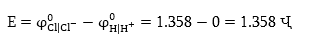
Այդ էլեկտրաշարժ
ուժն ուղղված կլինի
ջրածնականից դեպի
քլորայինը, այսինքն՝
հոսանքի աղբյուրի
էլշու-ին հակառակ,
ուստի աղաթթվի
էլեկտրոլիզը տեղի
կունենա միայն
այն դեպքում, երբ
հոսանքի աղբյուրի
էլշու-ն մեծ լինի
1.358 Վ-ից:
Միաժամանակ
գոյացած ջրածնական
և քլորային էլեկտրոդների
էլեկտրոդային
պոտենցիալները
կտարբերվեն բերված
ստանդարտ արժեքներից,
քանի որ այս դեպքում
ստացված էլեկտրոդների
միջոցով դրսից
հոսանք է անցնում:
Արտաքին այս լարման
ազդեցության տակ
կատոդի . պոտենցիալը
տեղաշարժվում
է դեպի ավելի բացասական
կողմը, անոդինը՝
դեպի ավելի դրական
կողմը: Այդ տեղաշարժված
մեծությունը կոչվում
է գերլարում:
պոտենցիալը
տեղաշարժվում
է դեպի ավելի բացասական
կողմը, անոդինը՝
դեպի ավելի դրական
կողմը: Այդ տեղաշարժված
մեծությունը կոչվում
է գերլարում:
Եթե հոսանքատար
էլեկտրոդըի պոտենցիալը
նշանակենք ապա
գերլարումը կլինի
ապա
գերլարումը կլինի
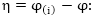
Գերլարման
մեծությունը կախված
է էլեկտրոդի նյութից,
դրա վրա լիցքաթափվող
իոնների տեսակից,
էլեկտրոդի միավոր
մակերեսի վրա հոսանքի
ուժից (հոսանքի
խտություն): Հատկապես
մեծ արժեք ունի
կատոդի վրա ջրածնի
անջատման գերլարումը:
Օրինակ՝ ցինկից
պատրաստված կատոդի
վրա ջրածնի անջատման
գերլարումը 0.7 4 է:
Հետևաբար էլեկտրոլիզի
պրոցեսի ընթացման
համար հոսանքի
աղբյուրի էլշու-ն
պետք է կատոդի
և անոդի վրա տեղի
ունեցող գերլարումների
չափով ևս մեծ լինի:
Որոշ լրացուցիչ
լարում անհրաժեշտ
է լուծույթի դիմադրությունը
հաղթահարելու
համար: Այս գումարներից
առաջանում է այն
անհրաժեշտ նվազագույն
լարումը, որը բավարար
է էլեկտրոլիզի
պրոցեսի ընթացքի
համար: Անհրաժեշտ
այդ լարումը կոչվում
է քայքայման պոտենցիալ:
>>
9.2.6. էլեկտրոլիզի
քանակական բնութագիրը,
Ֆարադեյի օրենքները
Քանակական
տեսակետից էլեկտրոլիզը
բնութագրվում
է Ֆարադեյի օրենքովներով:
I օրենք
էլեկտրոլիզի
ժամանակ էլեկտրոդների
վրա անջատված նյութի
զանգվածը ուղիղ
համեմատական է
էլեկտրոլիտի միջոցով
անցած էլեկտրականության
քանակությանը

որտեղ
m-ը էլեկտրոդի
վրա անջատված նյութի
զանգվածն է, q-ն՝
էլեկտրոլիտի միջով
անցած լիցքի քանակությունը,
k-0՝ համարժեքության
գործակիցը կոչվում
է էլեկտրաքիմիական
համարժեք:
Բանաձևից
երևում է, որ եթե
q=1 կուլոն, ապա m=k, այսինքն՝
էլեկտրաքիմիական
համարժեքը հավասար
է անջատված նյութի
զանգվածին, եթե
էլեկտրոլիտով
անցնում է 1 կուլոն
լիցք:
II
օրենք
Տարբեր
էլեկտրոլիտների
միջով էլեկտրականության
նույն քանակ անցկացնելիս
անջատվում են ստացվող
նյութերի համարժեքներին
համեմատական քանակներ:
Ենթադրենք
էլեկտրական հոսանքը
հաջորդաբար անցնում
է աղաթթվի, պղնձի
քլորիդի և անագի
քլորիդի լուծույթներով
(նկ. 9.5):
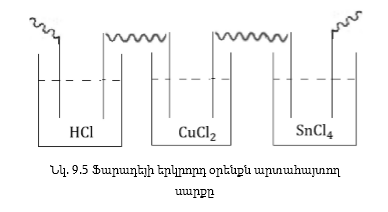
Պարզության
համար ընդունենք,
որ մեզ հաջողվել
է լուծույթներով
անցկացնել NA էլեկտրոն:
Էլեկտրոդների
վրա կանջատվեն
NA ջրածնի ատոմներ,
քանի որ ջրածնի
յուրաքանչյուր
իոն պահանջում
է մեկ էլեկտրոն,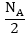 պղնձի
ատոմներ, քանի
որ պղնձի յուրաքանչյուր
իոն պահանջում
է երկու էլեկտրոն
և համապատասխանաբար
պղնձի
ատոմներ, քանի
որ պղնձի յուրաքանչյուր
իոն պահանջում
է երկու էլեկտրոն
և համապատասխանաբար
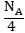 անագի
ատոմներ, իսկ NA
հատ ատոմները այդ
նյութերի մոլերն
են: Հետևաբար այդ
քանակները
անագի
ատոմներ, իսկ NA
հատ ատոմները այդ
նյութերի մոլերն
են: Հետևաբար այդ
քանակները 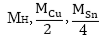 այսինքն
այսինքն
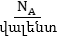 ջրածնի
, պղնձի և անագի
քիմիական համարժեքներն
են:
ջրածնի
, պղնձի և անագի
քիմիական համարժեքներն
են:
Ավոգադրոյի
թվով էլեկտրոնների
գումարային լիցքը
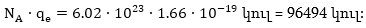
Այդ թիվը
կոչվում է Ֆարադեյի
թիվ (F):
Հետևաբար
F կուլոն լիցք անցկացնելիս
անջատվում է մեկ
քիմիական համարժեք
(Эq), իսկ որևէ q կուլոն
լիցք անցկացնելիս՝
mq:
F/q = Э/m, այստեղից
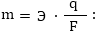
Քանի
որ 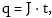 ապա
ապա

Այս բանաձևով
կարող ենք հաշվել
որևէ t ժամանակահատվածում
J հոսանքի ուժի
դեպքում անջատված
նյութի զանգվածը:
Օրինակ.
9.4.
Քանի գրամ
պղինձ կանջատվի
կատոդի վրա CuSO4 -
ի լուծույթի
էլեկտրոլիզի դեպքում
40 րոպեի ընթացքում,
եթե հոսանքի ուժը
1,2 Ա է:
Լուծում
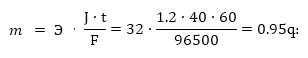
>>
9.2.7 Լուծվող
անոդով էլեկտրոլիզ
Եթե անոդը
պատրաստված է այնպիսի
մետաղից, որի ստանդարտ
էլեկտրոդային
պոտենցիալը ավելի
փոքր է, քան ջրի
էլեկտրաքիմիական
օքսիդացման կամ
անոդի վրա անիոնի
լիցքաթափման պոտենցիալները,
ապա տեղի է ունենում
անոդի մետաղի լուծում
(օքսիդացում): Եթե
էլեկտրոլիզի ենթարկենք
պղնձի սուլֆատի
լուծույթը, բայց
անոդը պատրաստենք
ոչ թե իներտ գրաֆիտից
կամ պլատինից
(ինչպես 9.2.2-ում) այլ
պղնձից, ապա անոդի
վրա տեղի կունենա
ոչ թե ջրի, այլ պղնձի
օքսիդացում, քանի
որ պղնձի օքսիդացման
պոտենցիալը (0.34 Վ)
շատ փոքր է ջրի
օքսիդացման պոտենցիալից
(1.228 Վ):
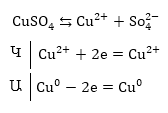
Անոդից պղինձը
կլուծվի և կնստի
կատոդի վրա:
>>
9.2.8 Էլեկտրոլիզի
կիրառություննրը
էլեկտրոլիզի
միջոցով արդյունաբերության
մեջ ստանում են
շատ մետաղներ,
իրականացնում
են մետաղների զտում
(ռաֆինացում), ճշգրիտ
մետաղական պատճենների
ստացում մետաղները
պատում այլ մետաղներով:
Մետաղների
միացությունների
հալույթների էլեկտրոլիզով
ստանում են խիստ
բացասական էլեկտրոդային
պոտենցիալներ
ունեցող մետաղներ:
Լարվածության
շարքում մինչև
ալյումինիումն
ընկած մետաղները
հիմնականում ստացվում
են այդ եղանակով:
Մետաղները
խառնուրդներից
մաքրելու համար
տեխնիկական մաքրության
մետաղներից պատրաստում
են ձողեր և տեղադրում
էլեկտրոլիտիկ
բջիջում՝ որպես
անոդ:
Օրինակ՝
տեխնիկական պղինձը
պարունակում է
շատ խառնուրդներ՝
մասնավորապես
արծաթ և ոսկի: Հոսանքը
միացնելիս անոդից
լուծվում են պղնձից
ակտիվ մետաղները
և պղինձը, որոնցից
կատոդի վրա նստում
է միայն պղինձը,
իսկ ոսկու և արծաթի
խառնուրդները
թափվում են ավազանի
հատակին՝ առաջացնելով
անոդային
շլամ:
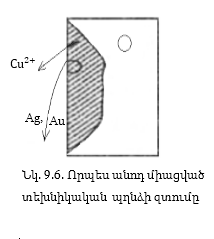
Կատոդի
վրա հավաքվում
է մեծ քանակության
պղինձ: Լուծույթում
մնացած պղվձից
ակտիվ մետաղների
իոնները պարբերաբար
հեռացվութմ են:
Կատոդի
մակերեսի պատումը
անոդի մետաղի նյութով
կոչվում է գալվանապատում:
Եթե կատոդի
մակերեսը լավ մաքրված,
յուղազրկված է,
նստած մետաղի շերտը
ամուր կպչում է
մակերեսին: Այդ
պրոցեսը կոչվում
է զալվանաստեգիա:
Գալվանաստեգիան
օգտագործվում
է մետաղները կոռոզիայից
պաշտպանելու, ինչպես
նաև արտաքին տեսքը
լավացնելու` էսթետիկական
նպատակների համար:
Եթե կատոդի
վրա նստած մետաղի
շերտն ամուր չի
կպչում նրա մակերեսին
և կարող է անջատվել՝
պրոցեսը կոչվում
է գալվանոպլաստիկա:Վերջինս
օգտագործվում
է ռելիեֆային մարմինների
ճշգրիտ պատճառներ
ստանալու համար:
>>
9. 3 . Մետաղների
կոռոզիա
9.3.1.Հիմնական
հասկացություններ
Մետաղների
կոռոզիա
կոչվում
է մետաղի ինքնաբերաբար
քայքայման պրոցեսը
շրջապատող միջավայրի
քիմիական ազդեցության
տակ: Հետևաբար
կոռոզիայի տեսակները
կախված պետք է
լինի միջավայրի
բնույթից: Եթե
մետաղները քայքայվում
են չոր գազերի
կամ ոչ էլեկտրոլիտ
հեղուկների միջավայրում,
կոռոզիան կոչվում
է քիմիական: Օրինակ՝
երկաթը թթվածնի
միջավայրում օքսիդանում
է մինչև Fe2Oз:

Քիմիական
կոռոզիան չոր գազերի
միջավայրում (գազային
կոռոզիա) տեղի
է ունենում բարձր
ջերմաստիճանում:
Եթե մետաղը
քայքայվում է էլեկտրոլիտների
միջավայրում, կոռոզիան
կոչվում է էլեկտրաքիմիական: Մաքուր
ջուրը էլեկտրոլիտ
չէ, սակայն բնական
ջուրը, շնորհիվ
իր մեջ լուծված
գազերի (CO2,SO2), զանազան
աղերի, համեմատաբար
լավ հաղորդիչ է,
և բնական ջրի ներկայությամբ
ևս ընթանում է
էլեկտրաքիմիական
կոռոզիա, իսկ քանի
որ բնական ջուր
կա ամենուրեք՝
օդում, հողի մեջ,
այդ պատճառով էլեկտրաքիմիական
կոռոզիան կոռոզիայի
շատ տարածված տեսակ
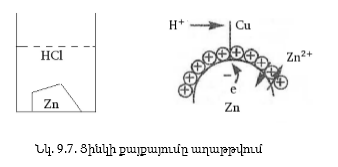
է: Քննարկենք էլեկտրաքիմիական
կոռոզիայի բնորոշ
դեպք, երբ մետաղը
(Zn)
գտնվում
է ուժեղ էլեկտրոլիտի,
օրինակ՝ աղաթթվի
մեջ (նկ.9.7): Ընդունենք,
որ ցինկը բացարձակ
մաքուր է:
Ջրի բևեռային
մոլեկուլների
ազդեցության տակ
մետաղական ցինկի
իոնները դուրս
կգան լուծույթ՝
էլեկտրոնները
թողնելով մետաղի
մեջ:
Zn - 2e
= Zn2+:
Քանի որ
մետաղական ցինկը
կբևեռանա բացասական
լիցքով, դուրս
եկած իոնները հեռու
չեն գնա մակերեսից,
կպատեն այն և պրոցեսը
արագ կհասնի հավասարակշռության,
կոռոզիան կդադարի:
Կոռոզիան կարող
էր շարունկվել,
եթե լուծույթում
գտնվող H+ իոնները
կարողանային վերցնել
մետաղական ցինկում
առաջացած էլեկտրոնների
ավելցուկը (ապաբևեռացնել
այն), սակայն մաքուր
ցինկի դեպքում
ամբողջ մակերեսը
պատված է Zn2+ իոններով,
որոնք թույլ չեն
տալիս H+- ին թափանցել
մինչև մետաղի մակերեսը:
Որպեսզի կոռոզիան
շարունակվի անհրաժեշտ
է H+ իոնների համար
էլեկտրոններ վերցնելու
հնարավորություն
ստեղծել: Դրա համար
կարելի է լուծույթի
մեջ ընկղմել և
հպել մետաղական
ցինկին մի էլեկտրոդ,
ցինկից պասիվ մետաղ,
օրինակ՝ պղնձի
ձող: Մետաղական
ցինկի մեջ գոյացած
էլեկտրոնների
ավելցուկը կանցնի
նաև պղնձի ձող
մեջ և վերջինիս
ազատ մակերեսի
վրա տեղի կունենա
ապաբրեռացումը՝
2H+ + 2e = H2:

Հավասարակշռությունը
մետաղական ցինկի
և լուծույթի միջև
կխախտվի, և ցինկը
կշարունակվի լուծվել,
կառաջանա Zn-Cu գալվանական
զուլգ (նկ.9.7): Հետևաբար
էլեկտրաքիմիական
կոռոզիան ընթացավ,
երբ առաջացավ գալվանական
զույգ, ընդ որում՝
այդ զույգից քայքայվեց
առավել ակտիվը՝
ցինկը: Տեխնիկական
մաքրության ցինկը
աղաթթվում հեշտությամբ
քայքայվում է,
որովհետև դրա մեջ
պարունակվում
են խառնուրդներ,
որոնց հետ առաջանում
են բազմաթիվ միկրոգալվանական
զույգեր:
Ջրածնի
իոններով կարող
են օքսիդանալ այն
մետաղները, որոնց
պոտենցիալները
փոքր են - 0.41 Վ-ից
(9.1.6): Դրանք լարվածության
շարքում սկզբից
մինչև կադմիում
ընկած մետաղներն
են: Ապաբևեռացումը
կարող է իրականանալ
նաև ջրում լուծված
թթվածնով՝
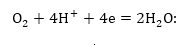
Այս պրոցեսի
պոտենցիալը 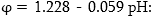 Չեզոք
միջավայրում
Չեզոք
միջավայրում 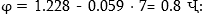 Հետևաբար
չեզոք միջավայրում
ջրային լուծույթում
թթվածինը կարոդ
է օքսիդացնել այն
մետաղները, որոնց
պոտենցիալը փոքր
է 0.8-ից: Դրանք սկզբից
մինչև արծաթ ընկած
մետաղներն են:
Էլեկտրաքիմիական
կոռոզիայի այդ
տեսակը, երբ մետաղը
օքսիդանում է ջրի
և թթվածնի առկայությամբ,
կոչվում է մթնոլորտային
կոռոզիա,
որը շատ տարածված
է: Քանի որ մթնոլորտում
կա խոնավություն,
այն ադսորբվում
է բոլոր նյութերի,
այդ թվում նաև
մետաղների մակերեսին:
Ջրի բևեռային մոլեկուլների
ազդեցության տակ
մետաղից (
Հետևաբար
չեզոք միջավայրում
ջրային լուծույթում
թթվածինը կարոդ
է օքսիդացնել այն
մետաղները, որոնց
պոտենցիալը փոքր
է 0.8-ից: Դրանք սկզբից
մինչև արծաթ ընկած
մետաղներն են:
Էլեկտրաքիմիական
կոռոզիայի այդ
տեսակը, երբ մետաղը
օքսիդանում է ջրի
և թթվածնի առկայությամբ,
կոչվում է մթնոլորտային
կոռոզիա,
որը շատ տարածված
է: Քանի որ մթնոլորտում
կա խոնավություն,
այն ադսորբվում
է բոլոր նյութերի,
այդ թվում նաև
մետաղների մակերեսին:
Ջրի բևեռային մոլեկուլների
ազդեցության տակ
մետաղից ( ) իոններն
անցնում են լուծույթ,
թողնելով էլեկտրոնները
մետաղի մեջ՝
) իոններն
անցնում են լուծույթ,
թողնելով էլեկտրոնները
մետաղի մեջ՝

Թթվածինը
վերցնում է այդ
էլեկտրոնները
և միանալով ջրի
հետ՝ վերածվում
է հիդրօքսիլ խմբերի՝
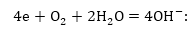
Fe2+ և OH-իոնները
առաջացնում են Fe(OH)2 ՝
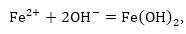
որն այնուհետև
օքսիդանում է թթվածնով՝
վերածվելով Fe(OH)3-ի՝
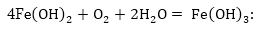
Առաջացած
գելանման Fe(OH)з-ը ջրարկվելով
բյուրեղանում
է` վերածվելով
FeOOH -ի ժանգի:
Էլեկտրաքիմիական
կոռոզիայի տեսակ
է նաև կոռոզիան
թափառող
հոսանքների
ազդեցության
տակ:
Էլեկտրական
սարքավորումները
ընդհանրապես հողակցվում
են, որի հետևանքով
հոսանքը հաճախ
թափանցում է հողի
մեջ, կուտակվում
ստորգետնյա խողովակաշարերում
և շարժվում դրանցով:
Այդ հոսանքների
ուժը մեծ քաղաքների
ստորգետնյա մետաղական
համակարգերում
լինում են շատ
մեծ և դրանց ազդեցության
տակ ևս ընթանում
է էլեկտրաքիմիական
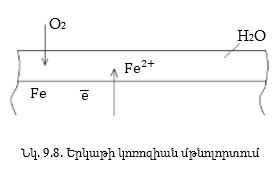
կոռոզիա: Ենթադրենք
էլեկտրագնացքի
ռելսը (նկ.9.8) ունի
ընդհատում և հոդի
տակ անցնում է
մետաղական խողովակաշար:
Ընդհատումը
շրջանցելու համար
հոսանքն անցնում
է հողի մեջ, մտնում
խողովակաշար և
վերադառնում ռելս:
Առաջանում են կատոդային
և անոդային մարզեր,
և անոդային մարզերում
ռելսը և խողովակը
քայքայվում են:
>>
9.3.2. Մետաղների
պաշտպանումը կոռոզիայից
Մետաղների
կոռոզիան վնասարար
երևույթ է ոչ միայն
տարեկան մետաղների
հսկայական քանակության
կորստի, այլ նաև
մետաղական առարկաների
փչացման հետևանքով,
այդ պատճառով մետաղների
պաշտպանումը կոռոզիայից
կարևոր խնդիր է:
Մետաղների կոռոզիան
տեղի է ունենում
դրանց մակերեսի
վրա՝ մետաղի և
միջավայրի շփման
սահմանում: Հետևաբար
սկզբունքորեն
մետաղները կոռոզիային
կարելի է պաշտպանել՝
1) փոխելով կոռոզիոն
միջավայրը; 2) մետաղի
մակերեսը մեկուսացնելով
միջավայրից; 3) էլեկտաքիմիական
եղանակներով:
Կոռոզիոն
միջավայրի փոփոխումը,
այն ավելի անվտանգ
դարձնելը միշտ
չէ, որ հնարավոր
է, այդ պատճառով
հիմնականում կիրառում
են մյուս մեթոդները:
Մետաղի մակերեսը
միջավայրից մեկուսացնում
են մեխանիկական
միջոցներով՝ պատելով
քսուկներով, ներկերով,
լաքերով, ապակու
(էմալ) շերտով և
այլ մետաղով, որը
պաշտպանման էլեկտաքիմիական
եղանակ է:
Եթե պաշտպանող
մետաղի շերտը հոծ
է, ապա ներսի մետաղը
լրիվ կպաշտպանվի
կոռոզիայից, սակայն
պաշտպանիչ շերտն
արվում է բարակ
և շահագործման
ժամանակ հեշտությամբ
առաջանում են քերծվածքներ,
որոնց հետևանքով
բացվում է ներսի
մետաղի մակերեսը:
Մետաղը
կարելի է պատել
կամ իրենից ակտիվ,
կամ իրենից ավելի
պասիվ մետաղով:
Քննարկենք այդ
երկու դեպքերը:
Ենթադրենք մի դեպքում
երկաթը պատված
է ցինկով, մյուս
դեպում՝ անագով,
և կա խորը քերծվածք,
որում գտնվում
է էլեկտրոլիտ
(նկ.Ց. 10):
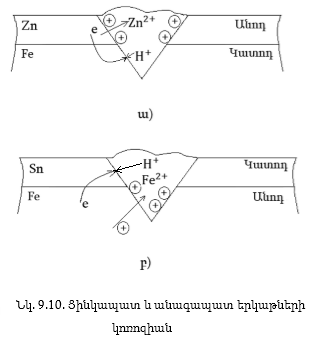
Ցինկապատ
երկաթի դեպքում
կառաջանա Zn-Fe գալվանական
զույգ (նկ.9.10ա): Ակտիվ
մետաղը՝ ցինկը
կքայքայվի՝ Zn - 2e
= Zn2+ գոյացած իոնները
կանցնեն լուծույթ
և կպատեն ցինկի
մակերեսը, էլեկտրոնները
կանցնեն նաև երկաթի
մեջ և դրա ազատ
մակերեսի վրա տեղի
կունենա ապաբևեռացում՝
2H+ + 2e = H2: Առաջացած
Zn-Fe գալվանական զույգում
Zn-ը կլինի անոդ, երկաթը՝
կատոդ, ուստի պաշտպանությունը
կլինի անոդային:
Անագապատ
երկաթի դեպքում
կլուծվի երկաթը
(ակտիվը), էլեկտրոնները
կանցնեն անագի
մեջ, և դրա վրա տեղի
կունենա ապաբևեռացում՝
2H+ + 2e = H2: Կառաջանա
Sn-Fe գալվանական զույգ,
որում անագը կլինի
կատոդ, իսկ երկաթը՝
անոդ, ուստի այդպիսի
պաշտպանությունը
կոչվում է կատոդային
(նկ.9.10բ): Բնականաբար
սրանցից ճիշտ պաշտպանությունն
է անոդայինը, որովհետև
քերծվածքի առկայության
դեպքում ևս պաշտպանվող
մետաղը (Fe) չքայքայվեց:
Հետևաբար մետաղը
կոռոզիայից պաշտպանելու
համար այն պետք
է պատել իրենից
ակտիվ մետաղով:
Այս սկզբունքը
խախտվում է միայն
այն դեպքերում,
երբ պատելու նպատակը
ոչ թե կոռոզիայից
պաշտպանելն է,
այլ արտաքին գեղեցիկ
տեսքը:
Անոդային
պաշտպանությունից
հետևում է պրոտեկտորային
(protect-պաշտպանել) պաշտպանության
գաղափարը, երբ
մետաղը կոռոզիայից
պաշտպանելու հասար
այն ոչ թե ամբողջությամբ
պատում են, այլ
դրան տեղ-տեղ կպցնում
են նույն միջավայրում
գտնվող որևէ ավելի
ակտիվ մետաղի կտորներ
(նկ.9.11ա):
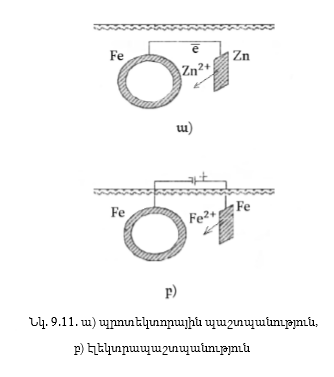
Ստորգետնյա
խողովակաշարը
կոռոզիայից պաշտպանելու
համար կարելի է
դրւսն տեղ-տեղ
կպցնել ցինկի թիթեղներ:
Ակտիվ մետաղը՝
ցինկը, կքայքայվի՝
Zn 2e = Zn2+ էլեկտրոնները
կանցնեն երկաթի
մեջ, և վերջինս
չի քայքայվի: Այստեղից
հետևում է, որ մետաղը
կոռոզիայից կարելի
է պաշտպանել՝
միացնելով հաստատուն
հոսանքի աղբյուրի
բացասական բևեռին,
դրական բևեռին՝
միացնելով նույն
միջավայրում գտնվող
այդ մետաղի մի
ուրիշ կտոր (նկ.9.11բ),
անոդը կքայքայվի,
էլեկտրոնները
անոդից կանցնեն
կատոդ, և կատոդը՝
կպաշտպանվի:
Որոշ մետաղներ
պաշտպանվում են
իրենց օքսիդի շերտով,
երբ մետաղի և օքսիդի
ընդարձակման գործակիցները
մոտավորապես հավասար
են: Այդպիսին է,
օրինակ, ալյումինը:
Գոյություն
ունեն նյութեր,
որոնք կոռոզիոն
միջավայրում դանդաղեցնում
են կոռոզիայի պրրոցեսը:
Դրանք կոչվում
են կոռոզիայի ինհիբիտորներ: Ինհիբիտորներ
են նատրիումի և
կալիումի քրոմատները
և դիքրոմատները,
նատրիումի ֆոսֆատը,
սիլիկատը և այլն:
Ինհիբիտորները,
փոխազդելով մետաղի
մակերեսի հետ,
առաջացնում են
բարակ թաղանթներ,
որոնք պասիվացնում
են մակերեսը:
>>
9.4. Էլեկտրակուտակիչներ
Էլեկտրակուտակիչներ
(լատ.
accumulate
-
կուտակել) կոչվում
են այն սարքերը,
որոնք ընդունակ
են դրսից տրված
էլեկտրական էներգիան
կուտակել իրենց
մեջ քիմիական էներգիայի
ձևով (լիցքավորում)
և անհրաժեշտության
դեպքում վերադարձնել
որպես էլեկտրական
էներգիա (լիցքաթափում):
Լիցքավորման ժամանակ
էլեկտրակուտակիչներում
ընթանում է էլեկտոոլիզի
պրոցես, իսկ լիցքաթափման
ժամանակ այն աշխատում
է որպես գալվանական
էլեմենտ:
Արդյունաբերական
էլեկտրակուտակիչներում
օգտագործվող էլեկտրաքիմիական
համակարգերն ըստ
էլեկտրոլիտի բաղադրության
լինում են երկու
տեսակի թթվային
և հիմնային:
Թթվային (կապարե)
էլեկտրակուտակիչներում,
որպես բացասական
էլեկտրոդ, վերցվում
է վանդակավոր կապարե
թիթեղ, լցված սպունգանման
կապարով, և դրական՝
լցված կապարի
(IV) օքսիդով: Թիթեղներն
ընկղմվում են ծծմբական
թթվի 35 -40% - անոց լուծույթ
պարունակող պլաստմասե
արկղի մեջ և մեկընդմեջ
միացվում իրար:
Այդ կոնցենտրացիայի
դեպում ծծմբական
թթվի լուծույթն
ունի առավելագույն
տեսակարար էլեկտրահաղորդականություն:
Սպառիչ միացնելիս
տեղի է ունենում
լիցքաթափում՝
օքսիդավերականգման
սեկցիա, ընդ որում՝
մետաղական կապարը
օքսիդանում է,
իսկ կապարի (IV) օքսիդը՝
վերականգնվում
է
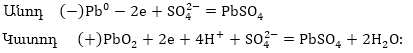
Էլեկտրոնները
արտաքին շղթայով
անցնում են կատոդից
անոդ և առաջանում
է հաստատուն հոսանք:
Յուրաքանչյուր
զույգը առաջացնում
է 2 վոլտ լարում:
Լիցքաթափման
գումարային հավասարումը
կլինի
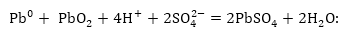
Երբ այս
ռեակցիան ավարտվում
է բոլոր էլեկտրոդների
պոտենցիալները
հավասարվում են,
և էլեկտրակուտակիչը
այլևս հոսանք տալ
չի կարոդ: Դրա համար
էլեկտրակուտակիչն
անհրաժեշտ է նորից
լիցքավորել՝ միացնելով
հաստատուն հոսանքի
արտաքին աղբյուրին:
Կապարի էլեկտրոդի
վրա տեղի է ունենում
վերականգնման
պրոցես.
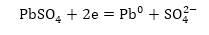
և այս էլեկտրոդը
դառնում է կատոդ,
կապարի օքսիդի
էլեկտրոդի վրա
ընթանում է օքսիդացման
պրոցես.
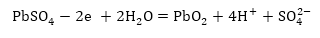
և այս էլեկտրոդը
դառնում է անոդ:
Գումարելով այդ
երկու հավասարումները՝
կստանանք լիցքավորման
գումարային հավասարումը
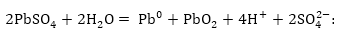
Դա լիցքաթափման
պրոցեսի հակառակ
ռեակցիան է, հետևաբար
էլեկտրակուտակիչի
ամբողջ աշխատանքը
կարելի է նկարագրել
այդ հավասարման
դարձելի տեսքով,
ընդ որում՝ ուղիդ
ռեակցիան ընթանում
է լիցքավորման,
հակառակը՝ լիցքաթափման
ժամանակ.
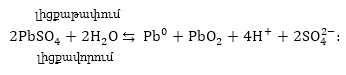
Եթե ընդունենք,
որ էլեկտրոդների
պոտենցիալները
համեմատական են
օքսիդացման աստիճանին
(օ.ա.), էլեկտրակուտակիչի
աշխատանքը կարելի
է արտահայտել գրաֆիկորեն
(նկ. 9.12).

Հիմնային էլեկտրակուտակիչներից
առավել տարածված
են երկաթ-նիկելային
էլեկտրակուտակիչները,
որոնցում որպես
դրական էլեկտրոդ
ծառայում է եռավալենտ
նիկելը (NiOOH խառնված
գրաֆիտի հետ), իսկ
բացասական էլեկտրոդ՝
սպունգային երկաթը
սնդիկի որոշ պարունակությամբ:
Կալիումի հիդրօքսիդը
էլեկտրոլիտ է:
Լիցքաթափման
պրոցեսում անոդի
վրա տեղի է ունենում
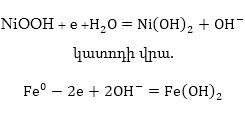
Լիցքավորման
ժամանակ տեղի են
ունենում հակառակ
պրոցեսները, հետևաբար
էլեկտրակուտակիչի
ամբողջ աշխատանքը
կարելի է
ներկայացնել
հետևյալ հավասարումով՝
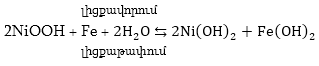
>>
Ամփոփում
Օքսիդացումը՝
տարրի ատոմի կամ
իոնի էլեկտրոն
կորցնելու հատկությունն
է, վերականգնումը՝
վերցնելու:
Օքսիդացման-վերականգնման
ռեակցիայում տեղի
ունի էլեկտրոնի
անցում մի ատոմից
մյուսը: Այդ ռեակցիաները
լինում են միջմռլեկուլայիններմոլեկուլային
և ինքնաօքսիդացման-
ինքնավերականգնման:
Ինքնաբերաբար
ընթացող օքսիդացման-վերականգնման
ռեակցիաներից
հնարավոր է ստանալ
հաստատուն հոսանք:
Այս սարքերը կոչվում
են գալվանական
էլեմենտներ:
Էլեկտրոլիզը,
ընդհակառակը, հոսանքի
ազդեցության տակ
հարկադրաբար ընթացող
օքսիդացման-վերականգնման
ռեակցիա է: Այն
լինում է երկու
տեսակի՝ լուծվող
և չլուծվող անոդով:
Լուծվող անոդով
էլեկտրոլիզը օգտագործվում
է գլավանապատում
իրականացնելու,
մետաղները մաքրելու
համար:
Մետաղների
կոռոզիան
դրանց
քայքայումն է շրջապատող
միջավայրի քիմիական
ազդեցության տակ
և լինում է երկու
տեսակի՝ քիմիական
և էլեկտրաքիմիական:
Մետաղները կոռոզիայից
պաշտպանում են
պաշտօանիչ ծածկույթներով
էլեկտրաքիմիական
մեթոդներով: էլեկտրակուտակիչները
սարքեր են, որոնցում
դրսից տրված էլեկտրական
էներգիան կուտակվում
է քիմիական էներգիայի
ձևով և վերադարձվում
որպես էլեկտրական
էներգիա: Լիցքավորման
պրոցեսում էլեկտրակուտակիչում
տեղի է ունենում
էլեկտրոլիզ, լիցքաթափման
ժամանակ այն աշխատում
է, որպես գալվանական
էլեմենտ:
>>
Սովորելու
նպատակը
Այս բաժինը
սովորելուց հետո
դուք պետք է կարողանաք,
1. Ձևակերպել
օքսիդացում, վերականգնում,
օքսիդիչ, վերականգնիչ,
օքսիդացման-վերականգնման
ռեակցիաներ հասկացությունները,
կազմել օքսիդացման-վերականգնման
ռեակցիաների հավասարումները,
էլեկտրոնային
հաշվեկշռի միջոցով:
2. Բացատրել
էլեկտրոդային
պոտենցիալի առաջացման
մեխանիզմը, իմանալ
դրա չափման ձևը,
կախումը մետաղի
իոնների կոնցենտրացիայից:
3. Կազմել
գալվանական էլեմենտ
և հաշվել դրա էլեկտրաշարժ
ուժը:
4. Բացատրել
մետաղների լարվածության
շարքի հիմնական
օրինաչափությունը
և հետևությունները
նրանից:
5. Կազմել
էլեկտրոլիտի կամ
նրա լուծույթի
էլեկտրոլիզի հավասարումները,
որոշել կատոդի
և անոդի վրա անջատվող
նյութերը, հաշվել
դրանց զանգվածները:
6. Տարբերել
մետաղների կոռոզիայի
տեսակները, գրել
ընթացող
պրոցեսների
հավասարումները,
իմանալ մետաղները
կոռոզիայից պաշտպանելու
եղանակաները:
7. Հասկանալ
էլեկտրակուտակիչներում
ընթացող պրոցեսները,
գրել ընթացող հավասարումները,
լիցքավորման և
լիցքաթափման ժամանակ:
>>
Հիմնական
հասկացություններ
1. Օքսիդացում կոչվում
է տարրի, ատոմի
կամ իոնի էլեկտրոն
կորցնելու պրոցեսը:
Վերականգնում
կոչվում
է տարրի, ատոմի
կամ իոնի էլեկտրոն
ընդունելու պրոցեսը:
2. Օքսիդիչ
կոչվում
է էլեկտրոններ
վերցնող, վերականգնիչ
կորցնող
տարրը:
3. Օքսհռացման
- վերականգնման
կոչվում
են այն ռեակցիաները,
որոնցում տեղի
ունի էլեկտրոնի
անցում մեկ ատոմից
մյուսը:
4. Օքսիդացման
- վերականգնման ռեակցիաները
լինում են ա) միջմոլեկուլային, բ)
ներմոլեկուլային, գ)
ինքնաօքսիդացման
- ինքնավերականգնման: Միջմոլեկուլային, որտեղ
օքսիդիչը և վերականգնիչը
գտնվում են տարբեր
մոլեկուլներում:
Ներմոլեկուլային, որտեղ
օքսիդիչը և վերականգնիչը
գտնվում են նույն
մոլեկուլի մեջ:
Ինքնաօքսիդացման
- ինքնավերականգնման, երբ
նույն տարրը հանդես
է գալիս և որպես
օքսիդիչ, և որպես
վերականգնիչ:
5. Օքսիդացման
- վերականգնման ռեակցիաներում
օքսիդիչ նյութի
վերցրած էլեկտրոնների
թիվը հավասար է
վերականգնիչ նյութի
կորցրած էլեկտրոնների
թվին:
6. էլեկտրոնային
պոտենցիալ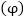 կոչվում
է պոտենցիալների
այն տարբերությունը,
որն առաջանում
է մետաղի թիթեղի
և իր աղի լուծույթի
միջև հավասարակշռության
պահին:
կոչվում
է պոտենցիալների
այն տարբերությունը,
որն առաջանում
է մետաղի թիթեղի
և իր աղի լուծույթի
միջև հավասարակշռության
պահին:
7. Ստանդարտ
էլեկտրոդային
պոտենցիալ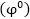 կոչվում
է էլեկտրոդային
պոտենցիալը, երբ
լուծույթում մետաղի
իոնների կոնցենտրացիան
1 մոլ/լ է՝ չափված
ջրածնական էլեկտրոդի
միջոցով:
կոչվում
է էլեկտրոդային
պոտենցիալը, երբ
լուծույթում մետաղի
իոնների կոնցենտրացիան
1 մոլ/լ է՝ չափված
ջրածնական էլեկտրոդի
միջոցով:
8. Գալվանական
էլեմենտ կոչվում
է այն սարքը, որում
ինքնաբերաբար
ընթացող օքսիդացման-վերականգնման
ռեակցիայից ստացվում
է էլեկտրական հոսանք:
9. Գալվանական
էլեմենտի էլշու-ն
հավասար է օքսիդիչի
պոտենցիալի և վերականգնիչի
պոտենցիալի տարբերության:
10. Էլեկտրոլիզ
է կոչվում էլեկտրական
հոսանքի ազդեցության
տակ հարկադրաբար
ընթացող օքսիդացման-վերականգման
ռեակցիան:
11. Էլեկտրոլիզ
կոչվում է չլուծվող
անոդով, երբ էլեկտրոդները
պատրաստված են
պրոցեսի համար
իներտ նյութերից,
լուծվող անոդով՝
երբ անոդը պատրաստված
է ակտիվ մետաղից,
որը պրոցեսի ընթացքում
օքսիդանում է:
12. Կատիոնների
լիցքաթափումը
էլեկտրոլիզի պրոցեսում
կատարվում է լարվածության
շարքի հակառակ
ուղղությամբ: Ջրային
լուծույթներից
էլեկտրոլիզ դեպքում
Fe-ից մինչև H ընկած
մետաղները լիցքաթափվում
են ջրածնից առաջ:
Անիոններից նախ
լիցքաթափվում
են պարզերը (Cl-
,S2-), հետո OH- նոր՝
բարդերը
13. Գալվանապատումը,
որպես կատոդ վերցված
իրի մերկերեսի
պատումն է այլ
մետաղով Այն կոչվում
է գալվանոստեգիա,
երբ նստած մետաղի
շերտն ամուր կպչում
է իրիմակերեսին
և գալվանոպլաստիկա,
երբ կարող է շերտով
պոկել մակերեսից:
14.Մետաղների
կոռոզիան մետաղների
քայքայման պրոցեսն
է շրջապատող միջավայրի
քիմիական ազդեցության
տակ: Քիմիական
կոռոզիան մետաղի
քայքայումն է
չոր գազերի և ոչ
էլեկտրոլիտ հեղուկների
միջավայրում: Էլեկտրաքիմիան
կոռոզիան մետաղի
քայքայումն է էլեկտրոլիտների
միջավայրում:
15. Մետաղների
անոդային պաշտպանությունը
կոռոզիայից մետաղի
պաշտպանումն է
իրենից ակտիվ մետաղով,
կատոդայինը՝
իրենից պասիվ մետաղով:
16. Ինհիբիտորներ
կոչվում են այն
նյութերը, որոնք
դանդաղեցնում
են կոռոզիայի պրոցեսը:
17. էլեկտրակուտակիչներ
կոչվում են այն
սարքերը, որոնք
կուտակում են իրենց
մեջ դրսից տրված
էլեկտրական էներգիան
քիմիական էներգիայի
ձևով և կարող են
նորից վերադարձնել
որպես էլեկտրական
էներգիա:
18. Թթվային
(կապարե) էլեկտրակուտակիչներում
էլեկտրոդները
Pb0 և PbO2 են, էլեկտրոլիտը՝
H2SO4: Հիմնային
(երկաթ-նիկելային)
էլեկտրակուտակիչներում՝
NiOOH և Fe, էլեկտրոլիտը՝
KOH:



![]() ուստի
ջրածնի օքսիդացման
աստիճանը կլինի
+1, իսկ քլորինը՝
-1:
ուստի
ջրածնի օքսիդացման
աստիճանը կլինի
+1, իսկ քլորինը՝
-1: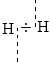
![]()

![]()
![]() և պերօքսիդների`
և պերօքսիդների`
![]()
![]() նշանակելով
Mnի օքսիդացման
աստճանը x-ով՝ կունենանք
նշանակելով
Mnի օքսիդացման
աստճանը x-ով՝ կունենանք
![]() ուստի x =
+7; կալիումի դիքրոմատում՝
ուստի x =
+7; կալիումի դիքրոմատում՝![]()
![]() ուստի
x=+6:
ուստի
x=+6:![]()
![]()
![]() իոնում
իոնում
![]()
![]() Կան առանձին
բացառություններ
(Օրինակ Cu, Ag, Au, O, F):
Կան առանձին
բացառություններ
(Օրինակ Cu, Ag, Au, O, F):![]() Օրինակ
ածխածինը չորրորդ
խմբի տարր է, և նրա
նվազագույն օքսիդացման
աստիճանը կլինի
48=-4:
Օրինակ
ածխածինը չորրորդ
խմբի տարր է, և նրա
նվազագույն օքսիդացման
աստիճանը կլինի
48=-4:![]()
![]()
![]()


![]()
![]()
![]()
![]()
![]()
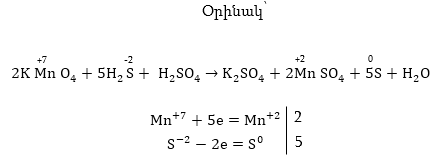
![]() բացի,
այստեղ մասնակցում
է երրորդ նյութ
բացի,
այստեղ մասնակցում
է երրորդ նյութ
![]() որպես
միջավայր: Հիմնական
գործակիցները
դնելուց և աջ ու
ձախ մասերը հավասարեցնելուց
հետո, ըստ աջ մասի
հաշվում ենք
որպես
միջավայր: Հիմնական
գործակիցները
դնելուց և աջ ու
ձախ մասերը հավասարեցնելուց
հետո, ըստ աջ մասի
հաշվում ենք![]() իոնների
թիվը՝ երեք, դնում
ծծմբական թթվին
գործակից, որից
հետո հաշվում ջրի
մոլեկուլների
թիվը:
իոնների
թիվը՝ երեք, դնում
ծծմբական թթվին
գործակից, որից
հետո հաշվում ջրի
մոլեկուլների
թիվը:![]()
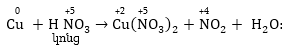
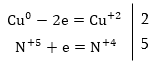
![]() իոնների
թիվը (2) և ավելացնում
HNO3-ի հիմնական
գործակցի վրա,
ոից հետո միայն
հավասարեցնում
ջրածնի ատամների
թիվը.
իոնների
թիվը (2) և ավելացնում
HNO3-ի հիմնական
գործակցի վրա,
ոից հետո միայն
հավասարեցնում
ջրածնի ատամների
թիվը.![]()
![]()
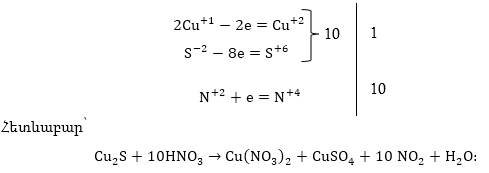
![]()
![]()
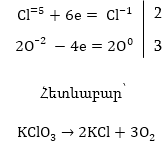
![]() - գործակիցը
կստացվի 2:
- գործակիցը
կստացվի 2:![]()
![]()